
中大新聞網訊(通訊員丁濤)人體菌群與多種疾病密切相關,精準調控菌群已經成為微生物組學的熱門科學問題。然而,人體菌群多樣性高、人群異質性大、組成和功能的動態復雜,實現菌群精準調控挑戰巨大;這其中解析微生物群落組裝機制至關重要。細菌群體感應(Bacterial quorum sensing, QS)作為細菌交換信息和相互作用的重要機制,具有普遍性、特異性和調控能力;但細菌QS是否如何調控人類微生物群落的組裝過程尚不清楚。
針對這一重要問題,中山大學中山醫學院丁濤課題組于2023年11月6日 在Microbiome雜志上在線發表了題為“Bacterial quorum sensing orchestrates longitudinal interactions to shape microbiota assembly”的研究論文。該研究中利用在體外搭建的優化的口腔生物被膜(oral biofilm microbiota,OBM)的組裝平臺,真實模擬并追蹤了口腔生物被膜菌群OBM的組裝全過程。結合體外模型培養,宏基因組測序,高通量數據分析以及信號干擾實驗,該研究發現OBM的組裝過程中,依次處于優勢地位的核心菌Streptococcus, Veillonella-Megasphaera group和Prevotella-Fusobacteria group,通過時序性的QS網絡進行信息交流實現菌種間互作,推動菌群結構的序貫演替。
作者利用混合唾液、優化的培養基和厭氧工作站模擬人體口腔齦下真實環境,在體外搭建立了優化的體外口腔生物膜微生物群組裝(OBMA)模型,還原了OBM的特征組裝過程,獲得了OBM時序組裝過程中的宏基因組。
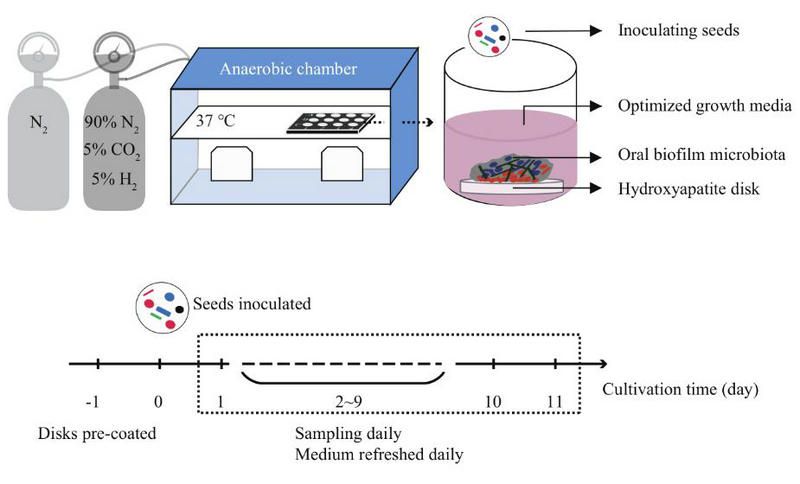
圖一:自主設計搭建的口腔菌群組裝體外模型OBMA
作者構建了細菌群體感應(QS)通路中信號合成和信號感應蛋白序列參考庫,并將其與時序OBM宏基因組進行同源比對,從中發現了2291個QS同源蛋白,涉及21條QS通路;這些QS通路大多在OBM中是首次發現,并在OBM組裝過程中呈現時序富集特點。經過對獲得的QS同源蛋白進行物種歸類分析,作者發現OBM中的QS通路主要來源自菌群組裝過程中時序富集的優勢物種,包括鏈球菌、韋榮氏球菌-巨球型菌、普雷沃菌-梭桿菌,這些菌作為核心樞紐構建了OBM組建過程中的核心QS縱向通訊網絡;進一步結合上述核心物種的富集時間、QS信號合成和感應蛋白類別及富集時間,作者發現QS信號在菌群通訊網絡中是雙向傳遞的,并對菌群組裝過程中的群落結構定向轉換具有關鍵作用。
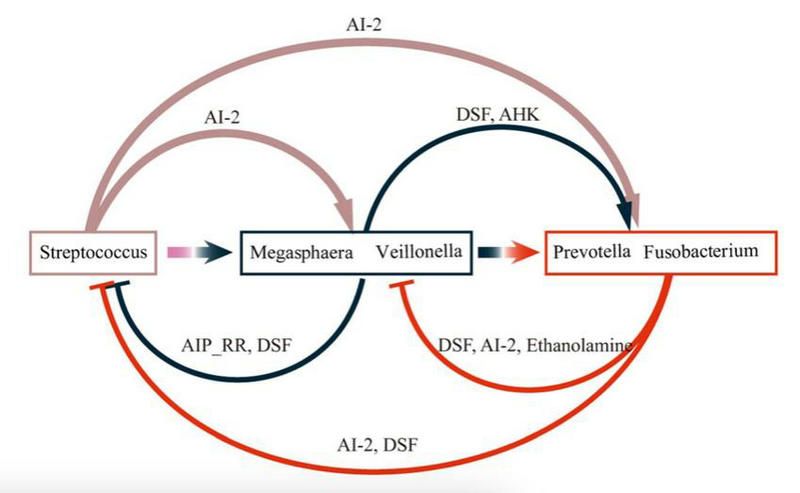
口腔菌群組裝過程中核心菌種通過QS信號分子進行雙向調控
為了驗證縱向QS網絡在裝配過程中的定向塑造能力,作者利用QS干擾實驗對菌群中的AI-2通訊網絡進行了阻斷干預,發現干擾淬滅菌群內的AI-2信號網絡后,OBM的組裝出現了延遲并且組裝成熟的被膜更為脆弱;其中早期定植的核心菌鏈球菌的增殖延長,而晚期定植的核心菌普雷沃菌和梭桿菌的增殖則被抑制。
該研究揭示了人類口腔生物被膜菌群過程中的縱向時序群體感應(QS)網絡,并通過實驗驗證了QS網絡在預測和操縱菌群裝配過程中的有效性。該工作為揭示自然復雜微生物群聚集的潛在機制提供了新的視角,并為通過干預QS網絡最終精確操縱人類菌群提供了重要的理論基礎。
中山大學中山醫學院丁濤課題組博士后蘇穎為論文的第一作者。丁濤教授為論文的通訊作者。該項目受到了國家自然科學基金、中國博士后科學基金和廣東省基礎和應用基礎研究基金的資助。
稍早前,丁濤教授團隊還在Gut Microbes雜志發表綜述“Targeting microbial quorum sensing: the next frontier to hinder bacterial driven gastrointestinal infections”(第一作者為蘇穎博士后),全面綜述了QS機制在病原菌驅動胃腸道感染的角色和作用,列舉了在胃腸道菌群中發現的QS信號以及它們參與調控菌群生理代謝功能的實例。
該論文討論了病原菌如何通過QS破壞胃腸道微生物群落平衡,菌群如何通過QS機制刺激宿主引發炎癥及腫瘤轉移以及宿主對致病菌群QS通訊的回擊策略。該綜述討論了基于菌群QS研發新型菌群療法的亟待解決的挑戰,并展望了這項工作的巨大前景和價值。
論文鏈接:
https://microbiomejournal.biomedcentral.com/articles/10.1186/s40168-023-01699-4