
神經系統的穩態可塑性是指當神經元突觸傳遞或興奮性持續改變時,細胞會代償性誘導突觸傳遞或興奮性向與原有變化相反的方向調整,從而使得突觸傳遞或興奮性維持在相對穩定的水平,以保證神經元和神經環路正常信息傳遞。神經系統穩態可塑性參與調控多種重要生理功能,如在覺醒-睡眠周期中,神經元放電出現持續性改變,其可通過穩態可塑性調控突觸的結構和功能。穩態可塑性異常也與自閉癥等神經/精神疾病相關,穩態可塑性在自閉癥小鼠模型中存在異常,被認為是自閉癥產生的分子機制之一。
自上世紀90年代Gina Turrigiano和Eve Marder等提出穩態可塑性概念以來,針對突觸傳遞穩態方面的研究已取得較大進展,但有關興奮性穩態的研究一直未有突破。
近日,我校中山醫學院李勃興教授團隊與紐約大學Richard W. Tsien教授團隊合作發現了興奮性穩態調控的分子機制。課題組使用鈉通道阻斷劑(TTX)阻斷動作電位以模擬神經元興奮性的長期降低。在TTX撤除后,動作電位的持續時間顯著延長,神經元興奮性代償性增加,提示神經元出現了興奮性穩態調控現象。機制研究發現,上述興奮性穩態調控是由于Nova-2介導的鉀通道(BK通道)mRNA選擇性剪切降低所致。
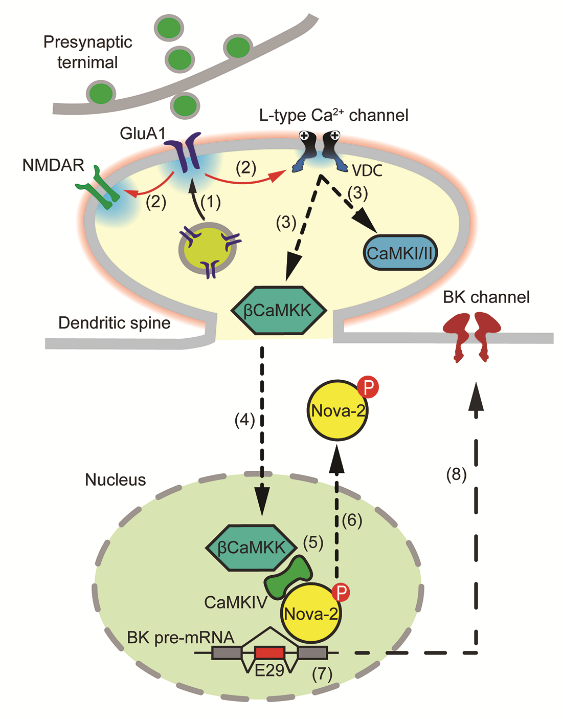
圖1. 調控神經元興奮性穩態的信號通路示意圖
值得注意的是,該研究發現長時間TTX處理神經元時,雖然神經元胞體不會產生動作電位,但是神經元突觸卻產生了明顯去極化,足以激活突觸部位的L-型鈣通道。后者通過其下游的鈣調蛋白激酶(βCaMKK和CaMKIV)將信息傳遞入細胞核,引起Nova-2磷酸化并向核外遷移,導致其介導的BK通道mRNA選擇性剪切下降(圖1)。
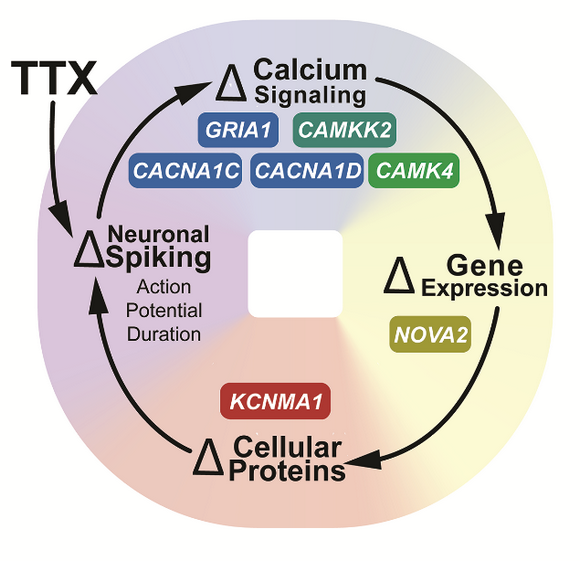
圖2. 穩態反饋環路
上述研究為近30年前提出的“穩態反饋環路”假說提供了完整證據(圖2)。考慮到該信號通路中多個分子(AMPA受體、L-型鈣通道、鈣調蛋白激酶家族、Nova-2、BK通道)與自閉癥、精神分裂癥、抑郁癥等神經/精神疾病密切相關,提示該通路的異常可能是上述疾病發生的重要機制。
上述創新性工作最近被Cell雜志接受并已在線發表“Neuronal inactivity co-opts LTP machinery to drive potassium channel splicing and homeostatic spike widening”,中山醫學院李勃興教授和紐約大學Richard W. Tsien教授為共同通訊作者,中山醫學院黃瀲滟教授、孫逸仙紀念醫院助理研究員羅爭意博士、2018級博士研究生魏川川同學和2018級碩士研究生游思坤同學對該研究具有重要貢獻。該研究得到國家及廣東省多項科研經費資助。