
6月11日,中國科學院院士、我校孫逸仙紀念醫院院長宋爾衛教授團隊在國際知名期刊Nature(《自然》)雜志在線發表了題為“DNA of neutrophil extracellular traps promotes cancer metastasis via CCDC25”的研究論文。該研究發現腫瘤細胞膜上存在DNA感受器CCDC25,該DNA感受器通過識別胞外NET-DNA介導腫瘤遠處轉移。楊林檳博士為本文第一作者,宋爾衛教授、蘇士成教授為共同通訊作者,中山大學為唯一作者單位。
如果把腫瘤比作一顆種子,腫瘤微環境就是讓種子生根發芽的土壤。其實,除了腫瘤局部微環境,人體全身都屬于腫瘤的生態系統的一部分,遠處的器官組織也會與腫瘤發生相互作用,導致的結果就是腫瘤的遠處轉移。但這一過程究竟是怎樣發生的?
中性粒細胞是腫瘤微環境的重要組成部分,在腫瘤的遠處器官轉移中起著重要作用。既往多項研究發現,中性粒細胞在各種細胞因子、病原微生物或PMA、LPS等化合物刺激下,會將自身的核酸以及蛋白等物質釋放出來,形成以DNA為骨架,鑲嵌著彈性蛋白酶、髓過氧化物酶等顆粒蛋白的網狀樣結構,稱為中性粒細胞胞外捕獲網(Neutrophil Extracellular Traps, NETs)。最初的研究發現,NETs可以捕獲病原體,并通過局部高濃度的抗菌蛋白消滅病原體。近年來人們也發現,NETs里面的DNA成分即NET-DNA也參與了腫瘤的遠處轉移。但之前的研究更多的是集中在動物模型,NET-DNA在腫瘤患者遠處器官轉移的作用以及臨床意義仍不明確。此外,NET-DNA促進腫瘤轉移的機制也未得到詳細的闡述。
該課題組從臨床標本出發,發現NETs主要浸潤在乳腺癌、結腸癌患者的肝轉移組織,且血清NETs可以預測早期乳腺癌患者肝轉移的發生,提示在腫瘤發生肝轉移前,NETs可能浸潤于肝組織并促進腫瘤肝轉移的發生。
該課題的主要研究設計示意圖
為了明確NETs是否存在于腫瘤轉移前肝組織及作用,該研究通過原位注射以及脾臟注射構建乳腺癌肝轉移模型,發現NETs在腫瘤肝轉移前就已大量浸潤,且隨著肝轉移過程不斷上升。更重要的是,在小鼠體內抑制或者破壞NETs的形成,可以明顯減輕乳腺癌肝轉移的發生。
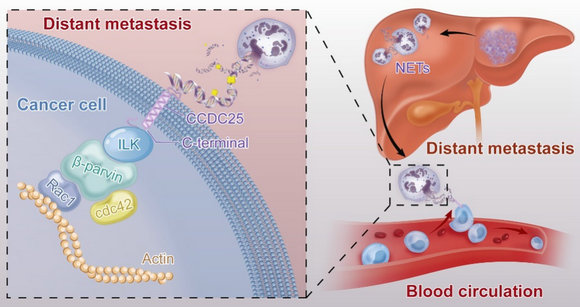
在機制方面,該課題組發現NET-DNA可以充當趨化腫瘤細胞運動的趨化因子,在不同小鼠模型中,發現肝臟或者肺組織中的NETs可吸引腫瘤細胞導致遠處轉移的發生。進一步研究發現,腫瘤細胞膜上存在NET-DNA受體CCDC25,CCDC25通過識別胞外的NET-DNA,激活ILK-β-parvin細胞骨架信號通路,增強腫瘤細胞的運動。既往研究認為DNA感受器主要位于胞內,該研究首次發現存在細胞膜上的DNA感受器。
尚未有研究深入探討CCDC25在腫瘤細胞中的作用,該蛋白是否可以成為治療靶點更是不為人知。該課題組通過多種模型進行驗證:1.在乳腺癌自發成瘤鼠(MMTV-PyMT)中敲除CCDC25; 2.乳腺癌細胞株以及原代乳腺癌細胞敲除CCDC25后接種于小鼠;3.在接種乳腺癌細胞株的小鼠腹腔注射中和抗體。實驗結果顯示:靶向CCDC25可以減少乳腺癌遠處器官轉移的發生。因此,該研究為乳腺癌患者遠處器官轉移提供新的靶點及治療策略。