
中大新聞網訊(通訊員張玉琦)抗生素的發現是人類歷史上最重要的生物醫學成就之一。然而,抗生素的大量使用促使抗微生物藥物耐藥性(Antimicrobial resistance,AMR)快速演化。每年死于AMR相關疾病的人數高達數百萬。開發新型抗生素是目前應對AMR的普遍策略,但新型抗生素研發周期長、難度大,因而亟需尋找新方法以遏制抗生素耐藥性。耐藥性的出現和傳播是自然選擇的過程,細菌面對逆境(如抗生素壓力)往往通過犧牲一部分適應性(Fitness)來獲得適應逆境的生存能力。一旦脫離逆境,這些適應性較低的菌株克隆容易被其他優勢群體所取代。與此同時,全球許多國家或地區試圖通過停用抗生素來遏制耐藥性的傳播。然而,禁用抗生素能否有效降低耐藥性的傳播存在很大爭議,如何提前評估禁抗策略的有效性是當前該領域亟需解決的關鍵問題。
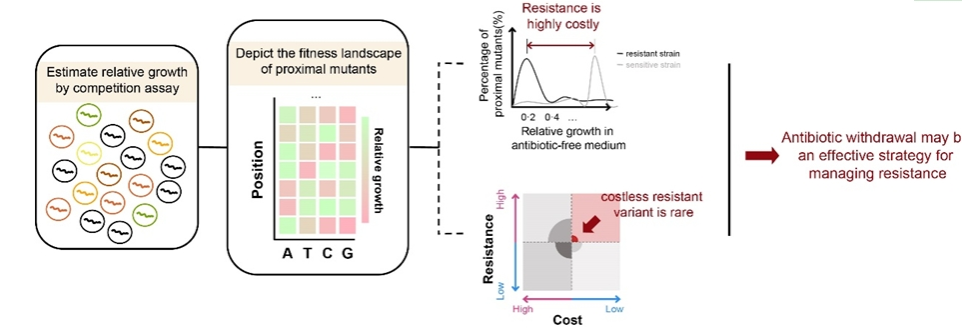
近日,中山大學楊建榮教授團隊、田國寶教授團隊和陳小舒教授合作團隊在Lancet Microbe在線發表題為“Assessment of the reversibility of resistance in the absence of antibiotics and its relationship with the resistance gene’s fitness cost: a genetic study with mcr-1”的研究論文。該研究聚焦多粘菌素耐藥基因mcr-1,首次提出假說:當細菌耐藥基因同時符合兩大條件時,禁抗策略將能有效降低耐藥性的傳播。這兩大條件包括:1)耐藥基因具有強適應性代價;2)耐藥基因近端突變體中不含(或少見)保留耐藥性且適應性代價低的突變體(costless-resistant variants)。
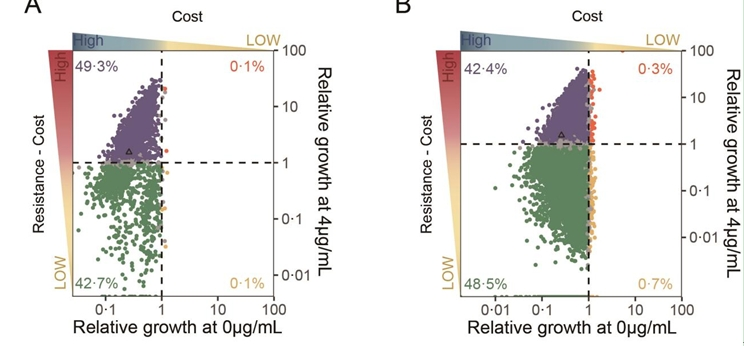
研究人員首先構建了mcr-1基因約15,000種突變體的質粒文庫,并將其轉入大腸桿菌受體菌中。將攜帶有野生型mcr-1、mcr-1突變體文庫和無功能mcr-1(對照)的大腸桿菌菌株克隆混合,置于不同濃度多粘菌素培養基中進行混合培養,并利用深度測序技術分析混合培養不同時間點各種突變體頻數的變化,計算它們相對于對照菌的相對生長速率。結果顯示,在無多粘菌素環境中,野生型mcr-1陽性大腸桿菌的相對生長速率下降了73.8%,提示野生型mcr-1基因具有很強的適應性代價。同時,單點突變體中,無適應性代價或低適應性代價的突變體非常罕見(約0.1%,3/3449,下圖);即使納入進化上更難發生的多點突變體,無適應性代價或低適應性代價的突變體比例也很低(約0.3%,43/14741,下圖)。以上結果說明mcr-1基因確實符合禁抗策略奏效的兩大條件。
為進一步理解上述現象,研究人員分析了帶有提前終止密碼子的突變體。結果表明,由于MCR-1從N端到C端依次為跨膜結構域、連接結構域和催化結構域,而MCR-1抗性的維持依賴于其編碼的完整催化結構域,而適應性代價則只需要完整的跨膜結構域和連接區域,因此無義突變無法在消除適應性代價的同時保留耐藥性。
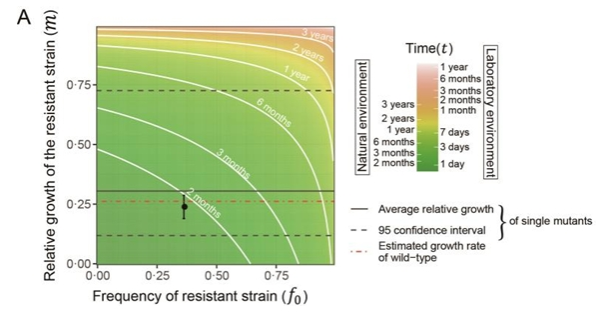
最后,為了驗證真實世界中MCR-1適應性代價與其流行率變化之間的關系。研究人員通過比較我國禁用多粘菌素作為飼料添加劑的政策實施以來,住院患者中mcr-1流行率的動態變化,利用擬合群體遺傳學模型,依據真實世界中mcr-1的消退速度估算其適應性代價。結果顯示,真實世界的數據(生長速率比無mcr-1菌株慢76.2%。圖中黑點)與上述在實驗室獲得的數據(生長速率比對照菌慢73.8%。圖中紅色虛線)非常吻合。
綜上所述,該研究闡明在沒有多粘菌素抗性選擇壓力下mcr-1流行率會下降,且可以基于群體遺傳學模型估算mcr-1流行率下降的速率。同時,該研究還揭示當耐藥基因具有較高且無法被簡單突變消除的適應性代價時,可以通過限制相應抗生素的使用來控制甚至逆轉耐藥性(如下圖)。該論文研究結果為遏制耐藥性的傳播及相關政策的制定提供了新思路。
中山大學楊建榮教授、田國寶教授和陳小舒教授為共同通訊作者,團隊成員郭梓妍同學、馮思源副教授、梁露潔博士和吳卓幸博士為文章的并列第一作者。
論文鏈接:https://doi.org/10.1016/S2666-5247(24)00052-1