
中大新聞網訊(通訊員鄭敏珊、趙現廷)近日,中山大學腫瘤防治中心楊江課題組聯合微創介入治療科范衛君課題組在Advanced Materials期刊上在線發表了題為“器官靶向性二氧化鉿納米藥物通過多擬酶活性抑制輻射導致的組織損傷”的論文,報道了一種具有器官靶向選擇性、多種仿生酶催化活性的二氧化鉿納米藥物。研究發現依靠Hf(0)/Hf(IV) 氧化還原對,能有效清除放療中產生的活性氧 (ROS),保護正常組織免受輻照所致的炎性損傷,具有“放療減毒”并降低炎性損傷風險的臨床轉化潛力。該研究首次揭示了二氧化鉿的輻射防護效應,為放療保護提供了一種新的設計思路。
放射治療是最常規的腫瘤治療手段之一,但通常會對正常組織產生全身或局部的脫靶毒性,引起急性或慢性輻射綜合癥,造成器官損傷。因此,在保證放療對癌細胞的充分殺傷前提下,放療引發的正常組織損傷、毒副作用和后遺癥是限制放療效果的重要因素。盡管目前已有氨磷汀和帕利弗明等藥物被批準用于輻射防護,但其有限的防護效果、短半衰期、較差的穩定性和臨床副作用限制了相關藥物的廣泛臨床應用。
由國際純粹與應用化學聯合會(IUPAC)選出的2022年十大科技進展之一為具仿生酶活性的納米酶。盡管其具有清除自由基、降低氧化應激的特性,但缺乏靶向性的缺點使其不可避免地有脫靶藥理作用。為了解決這一難題,中山大學腫瘤防治中心楊江課題組聯合微創介入治療科范衛君課題組進行了相關研究。研究報道了一種具有器官靶向選擇性、多種仿生酶催化活性的二氧化鉿納米藥物,依靠Hf(0)/Hf(IV) 氧化還原對,能有效清除放療中產生的活性氧(ROS),保護正常組織免受輻照所致的炎性損傷,具有“放療減毒”并降低風險的臨床轉化潛力。該研究首次揭示了二氧化鉿的輻射防護效應,顛覆了此前其僅能作為放療增敏劑的常規認知。
目前,由法國上市公司Nanobiotix研發的first-in-class放療增敏的二氧化鉿(HfO2)納米藥物Hensify? (NBTXR3),獲美國食品藥品監督管理局(FDA)授予快速通道資格,在歐洲和美國已獲批用于放療增敏治療頭頸部鱗狀細胞癌(HNSCC),同時在中國也已進入三期臨床試驗。
器官靶向性二氧化鉿納米顆粒(SORT HfO2 NPs)通過金屬前驅物在堿性環境下結合α-乳清蛋白(α-LA)反應形成。能譜CT成像可見,不同大小的SORT HfO2 NPs能選擇性靶向駐留在特定的放射敏感性指數(RSI)較低的正常器官肺、肝臟和腎臟中。SORT HfO2 NPs具備多種擬酶活性,能清除包括O2?-、OOH? 、OH? 和 H2O2等多種ROS。其能通過催化清除放療所致的自由基,能有效防護放射敏感的組織器官免受輻照所致的放射損傷。
在小鼠及兔子全身輻照模型中,SORT HfO2 NPs能恢復機體內受損的抗氧化防御系統,并延長動物的生存時間,特異性靶向降低組織內的炎癥水平。通過RNA測序分析,SORT HfO2 NPs能抑制FoxO、Hippo及TGF-β通路來降低細胞內放療所致的炎癥反應。綜上所述,該研究首次揭示了二氧化鉿的輻射防護作用,為放療保護提供了一種新的設計思路,結合其器官靶向及CT造影的特性,使其有潛力成為一種縮短輻照持續時間或增加劑量的放療保護性藥物。
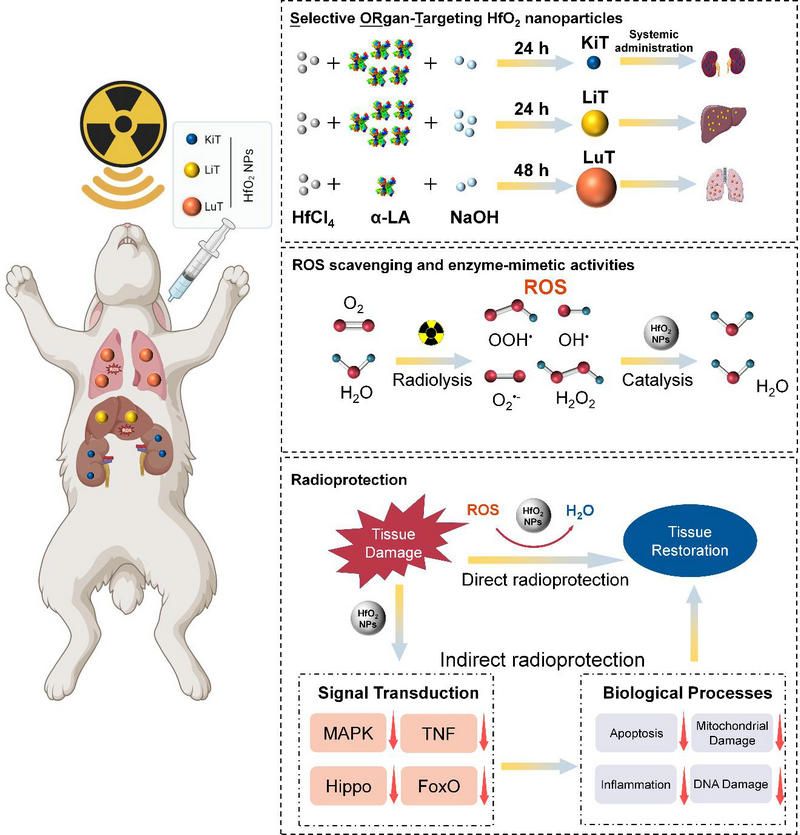
SORT HfO2 NPs對小鼠和兔子的器官靶向性放射防護及其作用機制
中山大學腫瘤防治中心、華南惡性腫瘤防治全國重點實驗室楊江研究員與微創介入治療科范衛君教授為論文的共同通訊作者。中山大學腫瘤防治中心劉鼎鑫博士、微創介入治療科曹飛博士后、佛山市第一人民醫院影像科徐志鋒主任醫師為本文共同第一作者。中山大學腫瘤防治中心劉澤先研究員、趙春花博士、劉澤坤博士后、龐家棟博士后、新西蘭奧塔哥大學Mahdieh Moghiseh博士、Anthony Butler教授及Perkin Elmer公司梁少霞參與了研究。該研究工作得到了國家重點研發計劃、國家自然科學基金、廣東省自然科學基金、廣東省重點研發計劃等項目的支持。
論文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/adma.202308098