
中大新聞網訊(通訊員李劍峰)CRISPR衍生的胞嘧啶/腺嘌呤堿基編輯器(CBE/ABE)由Cas9缺刻酶(nCas9)與胞苷或腺苷脫氨酶融合而成,能夠高效實現基因組C>T或A>G的堿基突變,對動植物基因功能研究、作物分子育種和人類遺傳病治療具有重要意義,被喻為CRISPR皇冠上的明珠。和CRISPR技術一樣,CBE/ABE也會因gRNA結合到基因組中與靶序列相似的序列而造成脫靶編輯(即gRNA依賴性脫靶)。近年來的研究進一步表明,CBE/ABE包含的胞苷或腺苷脫氨酶結構域會在動植物基因組和轉錄組中造成不可預測的DNA/RNA隨機脫靶編輯(即gRNA非依賴性脫靶)。這種隨機脫靶給CBE/ABE的廣泛應用帶來了負面影響。目前,解決gRNA非依賴性脫靶主要依賴點突變提高脫氨酶的高保真性或引入額外的脫氨酶活性調控元件。然而,提高脫氨酶特異性的點突變策略缺乏通用性,無法適用于不同序列/類型的脫氨酶,而且消除DNA和RNA脫靶的點突變疊加后可能會同時降低脫氨酶在靶位點的脫氨效率;引入脫氨酶調控元件則會增加系統的復雜性,也可能降低其通用性。
近日,中山大學生命科學學院李劍峰課題組在Nature Plants發表了題為“Split complementation of base editors to minimize off-target edits”的研究論文,報道了一種簡單普適的CBE/ABE脫靶消除策略,即SAFE(split deaminase for safe editing)策略。該策略能夠在水稻、擬南芥植株以及人、酵母細胞中實現高效、低脫靶的堿基編輯。Nature Plants同期以研究簡報的形式對該研究進行了推薦。
作者首先提出關于SAFE策略的構想:從插入nCas9內部的脫氨酶結構域將堿基編輯器拆分為N端和C端兩部分,使脫氨酶和nCas9同時失活,以防止脫氨酶的組成型活性造成gRNA非依賴性脫靶。在靶位點處,利用gRNA作為分子膠將拆分的兩部分穩定重構為具備完全活性的堿基編輯器,從而實現中靶編輯。作者隨后基于脫氨酶嵌入型CBE和ABE(即PIGS-AID10和PIGS-ABE8e),在胞苷脫氨酶AID10或腺苷脫氨酶TadA8e的無序區域內分別設計了7個候選拆分位點,利用植物原生質體瞬時表達系統和CBE/ABE的編輯活性報告系統對PIGS-AID10或PIGS-ABE8e的7種N端片段與7種C端片段之間形成的28種有效組合進行了重組編輯活性篩選。發現從AID10的Gly156-Arg157之間拆分PIGS-AID10或從TadA8e的Gly125-Met126之間拆分PIGS-ABE8e,可實現gRNA介導的中靶編輯。進一步,在水稻、擬南芥植株以及人HEK293T細胞、酵母中先后驗證了前述策略介導的中靶編輯效率并全面評估了脫靶效應,發現該策略確實能夠大幅抑制gRNA非依賴的基因組和轉錄組隨機脫靶編輯。意外的是,該策略同時還能夠降低gRNA依賴的DNA脫靶編輯,并且能夠完全抑制CBE造成的缺失或插入(indel)突變。總之,SAFE策略不僅全面提升了動植物中堿基編輯的安全性和產物純度,而且對不同脫氨酶變體組成的堿基編輯器通用,同時無需引入額外的脫氨酶活性調控元件。可預見的是,拆分后的堿基編輯器由于分子量變小,更利于病毒載體介導的堿基編輯器遞送和在作物與人細胞中的表達。
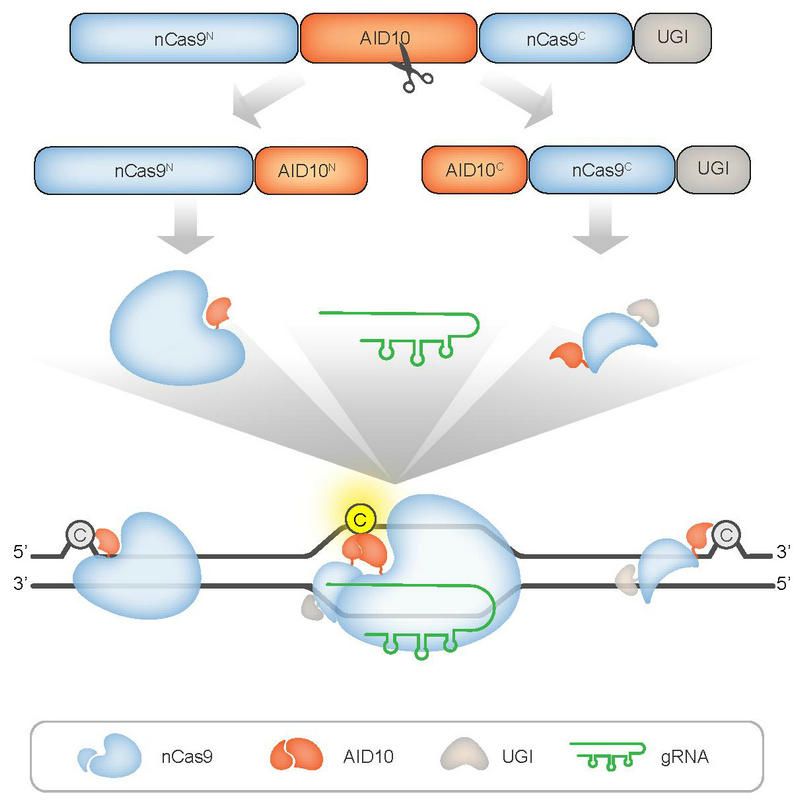
研究示意圖
中山大學已畢業博士生熊翔宇和博士后劉科輝為該論文的共同第一作者,李劍峰教授和博士后劉科輝為共同通訊作者。中山大學賀雄雷教授、博士后黎鎮祥、夏凡女和博士生阮雪銘參與了該研究。該研究得到國家重點研發計劃合成生物學專項等經費資助。