
中大新聞網訊(通訊員張玉琦)免疫療法因其在癌癥治療中能夠實現持久控制腫瘤進展并延長患者生存的潛力而備受矚目。樹突狀細胞(Dendritic cells,DCs)作為人體內功能最強大的專職性抗原呈遞細胞,在適應性抗腫瘤應答的形成過程中發揮關鍵性作用。然而,盡管近年來的研究在以DC作為治療性疫苗的領域中取得了一些突破性成就,但大多數患者并未獲得顯著的臨床益處。這是由于腫瘤細胞可通過多種機制,包括細胞因子以及免疫檢查點等方式,限制了DC的生存、遷移和浸潤,同時還抑制了DC的分化和成熟,使其無法有效啟動抗腫瘤T細胞應答。因此,如何克服免疫抑制的腫瘤微環境成為提高DC疫苗臨床治療效應所亟需解決的重要問題。
溶瘤病毒是一種利用天然或者遺傳修飾的病毒、選擇性殺傷腫瘤細胞而對正常細胞無害的新型治療策略。溶瘤病毒作為一種病原體,能夠激活機體中的抗病毒應答,調節全身免疫,改善腫瘤微環境,而其誘導分泌的抗病毒細胞因子I型干擾素(IFN)對DC功能和生存至關重要。在這一背景下,溶瘤病毒具有潛在的能力,可打破腫瘤微環境對DC疫苗的抑制、刺激DC疫苗的成熟、從而增強DC疫苗在臨床應用中的表現。
2023年10月11日,中山大學中山醫學院顏光美教授/林園教授團隊在Cell Reports Medicine上發表了題為“Oncolytic virus M1 functions as a bifunctional checkpoint inhibitor to enhance the antitumor activity of DC vaccine”的研究,該研究發現腫瘤細胞通過接觸依賴的信號調節蛋白α(Signal Regulatory Protein α,SIRPα)-CD47免疫檢查點通路抑制DC的成熟并削弱了DC疫苗的抗腫瘤活性,而溶瘤病毒M1(OVM)能夠分別下調DC中的SIRPα以及腫瘤細胞中的CD47,逆轉腫瘤對DC疫苗的抑制作用,從而提高DC疫苗在多種荷瘤小鼠模型中的治療效果,而這一作用可被PD-L1阻斷進一步增強。
該研究揭示了SIRPα-CD47在DC功能中的關鍵作用及其作為增效DC疫苗潛在靶點的可行性,并證實溶瘤病毒M1能通過降低免疫檢查點的表達來逆轉腫瘤免疫抑制的新功能,為DC疫苗的臨床應用提供了潛在的增效佐劑。
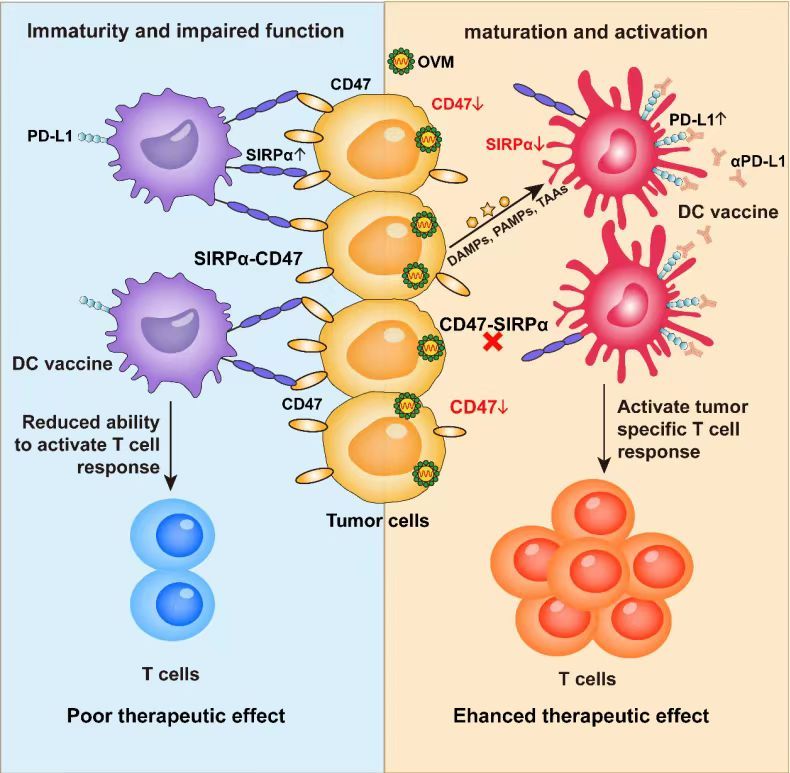
圖形摘要
論文鏈接:https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(23)00406-8