
中大新聞網(wǎng)訊(通訊員夏煒)光動(dòng)力療法(Photodynamic Therapy,PDT)是一種非侵入性治療方式,在個(gè)性化醫(yī)療中獲得了極大的普及。在特定波長(zhǎng)光的激發(fā)下,光動(dòng)力療法的核心——光敏劑將細(xì)胞組織中的分子氧轉(zhuǎn)化為高細(xì)胞毒性的活性氧物種(ROS),從而誘導(dǎo)腫瘤細(xì)胞死亡。憑借光穩(wěn)定性強(qiáng)等優(yōu)異的光物理性能,過(guò)渡金屬配合物(釕、銥和錸等)作為光敏劑受到越來(lái)越多的關(guān)注,其中金屬光敏劑的腫瘤靶向遞送策略也變得愈發(fā)重要。此外,越來(lái)越多的研究表明,由于固有的乏氧趨向性,靜脈注射的細(xì)菌通過(guò)血液循環(huán)系統(tǒng)能夠靶向、穿透腫瘤組織并在腫瘤部位定殖,因此細(xì)菌被認(rèn)為是靶向腫瘤的候選載體。
近日,中山大學(xué)化學(xué)學(xué)院的夏煒教授、毛宗萬(wàn)教授和溫州醫(yī)科大學(xué)的沈建良教授合作,開(kāi)發(fā)了一種新型銥(III)光敏劑-細(xì)菌雜交體(Ir-HEcN),其能夠靶向腫瘤部位,在光照下實(shí)現(xiàn)腫瘤的光動(dòng)力免疫治療。課題組首先對(duì)益生菌E. Coli Nissle 1917 進(jìn)行基因工程改造,使其表面過(guò)表達(dá)HaloTag蛋白,并合成了帶有氯代正己烷結(jié)構(gòu)的環(huán)金屬銥(Ⅲ)配合物IrCl。基于HaloTag蛋白與氯代正己烷結(jié)構(gòu)之間形成的共價(jià)鍵,IrCl可以穩(wěn)定地錨定在Nissle 1917 表面。(圖1)
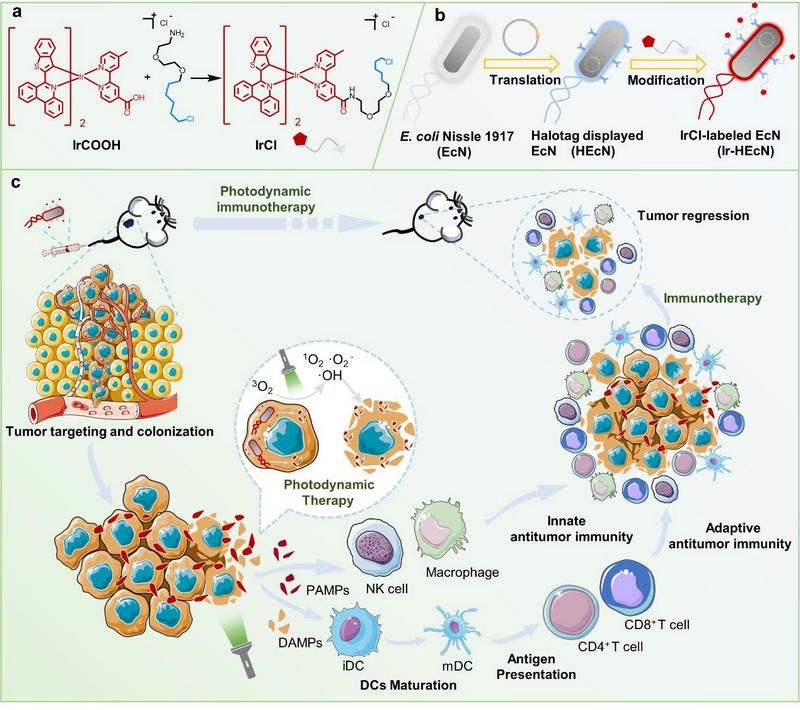
圖1 :(a)光敏劑IrCl的合成(b)銥(Ⅲ)光敏劑雜合體的構(gòu)建(c)通過(guò)光動(dòng)力免疫治療消除實(shí)體瘤的示意圖
相比于銥配合物,雜合體具有更優(yōu)異的腫瘤滲透性。此外,憑借Nissle 1917的腫瘤部位定殖特性,與銥配合物不同的是,雜合體具有更高的腫瘤靶向性。因此,在525 nm綠光的激發(fā)下,雜合體能夠顯著抑制乳腺腫瘤的生長(zhǎng)。最后,腫瘤部位的免疫細(xì)胞的流式分析結(jié)果表明:無(wú)論是先天性免疫的巨噬細(xì)胞和自然殺傷細(xì)胞,還是適應(yīng)性免疫的樹(shù)突狀細(xì)胞、CD4+ T細(xì)胞和CD8+ T細(xì)胞, 雜合體+光照組都表現(xiàn)出最高的浸潤(rùn)率。(圖2)
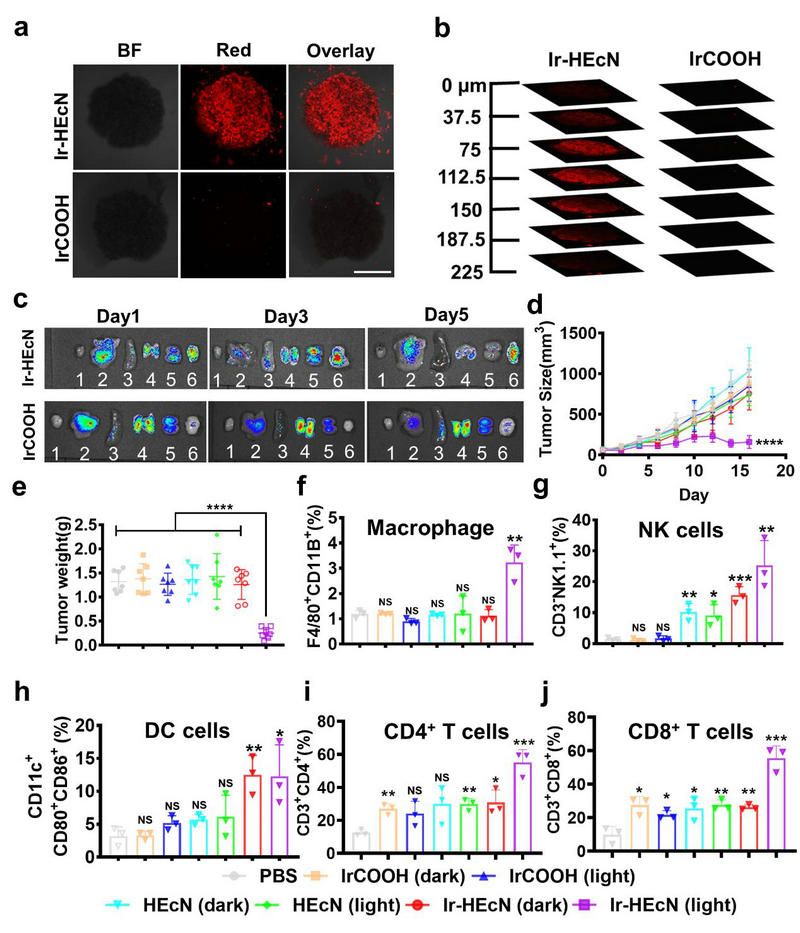
圖2. (a)(b)MDA-MB-231細(xì)胞球磷光成像 (c)荷瘤小鼠各器官及腫瘤離體成像(d)荷瘤小鼠腫瘤生長(zhǎng)曲線(e)荷瘤小鼠腫瘤體積(f)(g)(h)(i)(j)腫瘤部位免疫細(xì)胞浸潤(rùn)率
此項(xiàng)工作設(shè)計(jì)并構(gòu)建了第一例銥光敏劑修飾的細(xì)菌雜合體。在525 nm綠光的激發(fā)下,該雜合體會(huì)導(dǎo)致腫瘤細(xì)胞發(fā)生焦亡并促進(jìn)先天性免疫細(xì)胞(巨噬細(xì)胞、自然殺傷細(xì)胞)和適應(yīng)性免疫細(xì)胞(樹(shù)突狀細(xì)胞、CD4+ T細(xì)胞和CD8+ T細(xì)胞)的浸潤(rùn),最終實(shí)現(xiàn)腫瘤的光動(dòng)力免疫治療。此外,該腫瘤靶向策略也可能適用于其他抗腫瘤金屬藥物。
該研究成果發(fā)表在Angewandte Chemie International Edition上,并被評(píng)選為熱點(diǎn)文章。中山大學(xué)化學(xué)學(xué)院博士研究生林文凱和溫州醫(yī)科大學(xué)碩士生劉宇(現(xiàn)為中山大學(xué)化學(xué)學(xué)院博士研究生)為該論文的共同第一作者,溫州醫(yī)科大學(xué)的沈建良教授、中山大學(xué)化學(xué)學(xué)院的毛宗萬(wàn)教授和夏煒教授為該論文的通訊作者。本論文受到了國(guó)家重點(diǎn)研發(fā)計(jì)劃、國(guó)家自然科學(xué)基金和浙江省自然科學(xué)杰出青年基金等項(xiàng)目的支持。
論文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202310158