
在生命體系中,蛋白質(zhì)可組裝成高階的結(jié)構(gòu)以執(zhí)行特定的生物功能,這些蛋白結(jié)構(gòu)包括動(dòng)態(tài)聚合物(肌動(dòng)蛋白、微管蛋白等)、多維結(jié)構(gòu)(細(xì)菌s層、膠原蛋白等)及完整的晶體(如質(zhì)多角體病毒多面體)。這種生物組裝過(guò)程激發(fā)了科學(xué)家們對(duì)蛋白質(zhì)的新功能開(kāi)發(fā):即作為“構(gòu)建模塊”,設(shè)計(jì)具有非凡功能的生物納米結(jié)構(gòu)。基于計(jì)算機(jī)輔助的DNA-DNA互補(bǔ)配對(duì)和金屬配位誘導(dǎo)的蛋白質(zhì)組裝技術(shù)在該領(lǐng)域取得了顯著的進(jìn)展。然而,由于蛋白質(zhì)在形狀和表面基團(tuán)上固有的異質(zhì)性,截至目前,只有極少數(shù)蛋白質(zhì)可以通過(guò)上述技術(shù)組裝出明確結(jié)構(gòu)的材料體素。
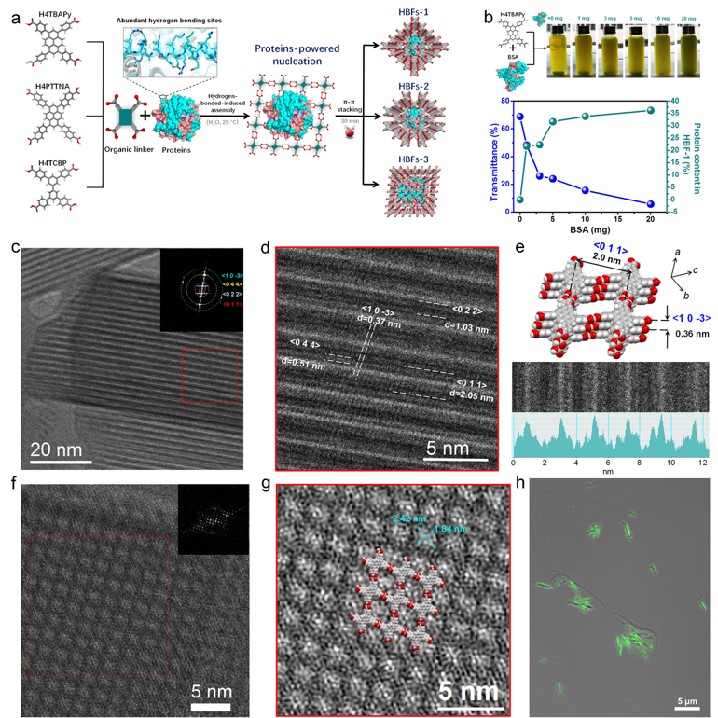
圖1. 蛋白質(zhì)導(dǎo)向的氫鍵組裝策略及雜交框架的冷凍電鏡結(jié)構(gòu)
有鑒于此,我校化學(xué)學(xué)院陳國(guó)勝副教授和歐陽(yáng)鋼鋒教授團(tuán)隊(duì)報(bào)道一種新的蛋白質(zhì)導(dǎo)向組裝策略 (圖1)。在該策略中,蛋白質(zhì)“模塊”通過(guò)氫鍵作用錨定有機(jī)配體,并借助配體間的π-π作用組裝成高度結(jié)晶的氫鍵生物雜交框架(Hydrogen-bonded biohybrid framework, HBF)。低電子劑量冷凍電鏡技術(shù)在單分子水平上剖析了HBF的晶體學(xué)結(jié)構(gòu),并證明蛋白質(zhì)在晶體框架中的單分散性。框架的蛋白質(zhì)含量最高可達(dá)67.4%(W/W),是目前報(bào)道的最高數(shù)值。此外,HBF具有極高的化學(xué)穩(wěn)定性,其孔徑結(jié)構(gòu)和蛋白質(zhì)約束緊密度均可通過(guò)調(diào)節(jié)有機(jī)配體的結(jié)構(gòu)進(jìn)行合理控制。當(dāng)用酶作為構(gòu)筑“模塊”時(shí),得到的酶框架在酶加載量、結(jié)構(gòu)穩(wěn)定性和催化效率等多方面均比先前報(bào)道的酶@ZIFs體系有大幅度的提升。這項(xiàng)工作揭示了氫鍵組裝策略在雜交框架設(shè)計(jì)的巨大潛力,在生物催化、傳感和納米醫(yī)學(xué)等方面具有廣闊的應(yīng)用前景。該研究成果以“Protein-directed, hydrogen-bonded biohybrid framework”為題發(fā)表在CHEM上。文章的第一作者是化學(xué)學(xué)院陳國(guó)勝副教授和孫逸仙紀(jì)念醫(yī)院黃思銘助理研究員,通訊作者是化學(xué)學(xué)院歐陽(yáng)鋼鋒教授。
本研究得到國(guó)家自然科學(xué)基金、廣東省自然科學(xué)基金和中央高校基本科研業(yè)務(wù)費(fèi)等項(xiàng)目的資助;同時(shí),獲得中山大學(xué)測(cè)試中心、南方科技大學(xué)冷凍電鏡中心和東南大學(xué)分析測(cè)試中心在相關(guān)測(cè)試方面的支持。