
中大新聞網(wǎng)訊(通訊員黃艷娟)腫瘤轉(zhuǎn)移是其致死的首要因素,其中骨轉(zhuǎn)移尤甚。乳腺癌的骨轉(zhuǎn)移發(fā)病率高達65~80%,繼而引起頑固性骨痛、脊神經(jīng)壓迫、高鈣血癥、骨折及骨溶蝕等致命性并發(fā)癥,嚴重降低患者的生存質(zhì)量。因此,有效防治乳腺癌及其遠端骨轉(zhuǎn)移是臨床之急需。
我校藥學院趙春順教授課題組長期專注于乳腺癌骨轉(zhuǎn)移治療研究,近日在權(quán)威期刊Nature communications雜志在線發(fā)表了題為“Engineered macrophages as near-infrared light activated drug vectors for chemo-photodynamic therapy of primary and bone metastatic breast cancer”的研究論文,并已申請1項中國發(fā)明專利(申請?zhí)枺篊N202110760793.7)。該研究基于乳腺癌骨轉(zhuǎn)移的疾病特征,整合奧沙利鉑前藥及光敏活性分子的優(yōu)勢,構(gòu)建了近紅外光激活型工程化巨噬細胞-前藥遞藥載體,旨在實現(xiàn)光控釋藥及化療-光動力(PDT)聯(lián)合治療的效果。
該細胞遞藥系統(tǒng)具有載藥量高、細胞活力高、遞藥效率高及藥物可控釋放等特性,于體內(nèi)可同步靶向到原發(fā)瘤及骨轉(zhuǎn)移瘤區(qū)域(如圖所示)。在原發(fā)腫瘤部位進行近紅外光照射,可激活光敏活性分子的光動力治療,實現(xiàn):①可控觸發(fā)并加速奧沙利鉑從細胞載體中的釋放,發(fā)揮其誘導細胞免疫原性死亡(immunogenic cell death, ICD)功能;②化療與光動力治療的聯(lián)合,不僅顯著抑制原發(fā)腫瘤,且能聯(lián)合誘導ICD的發(fā)生激活免疫系統(tǒng),促進樹突狀細胞(dentritic cells, DCs)成熟,并促進瘤內(nèi)CD8+T細胞和CD4+T細胞的浸潤,同時提高血清中IFN-γ和TNF-α的水平,與PD-L1抗體聯(lián)合后顯著抑制原發(fā)瘤及骨轉(zhuǎn)移瘤,并顯著緩解腫瘤轉(zhuǎn)移導致的骨溶蝕。此外,該化療-光動力-免疫聯(lián)合治療體系賦予了小鼠長期抗腫瘤免疫記憶效應(yīng),并顯著延長了小鼠的生存期,且生物相容性良好。
該工程化巨噬細胞遞藥載體的治療模式,為乳腺癌原發(fā)及骨轉(zhuǎn)移的治療提供了一種化療-光動力-免疫協(xié)同治療的新模式。
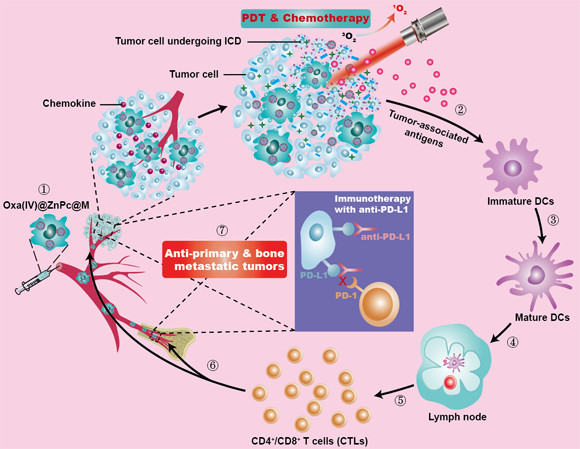
工程化巨噬細胞遞藥載體的作用機制示意圖
我校藥學院趙春順教授為論文的通訊作者,藥學院黃艷娟博士后為論文第一作者。該研究得到國家自然科學基金與中國博士后科學基金的經(jīng)費支持。