
中大新聞網訊(通訊員王海河)近日,中山醫學院王海河教授團隊、中山大學附屬第一醫院楊蜀嵐研究員團隊合作在Autophagy (2020 IF:16.016)發表題“Adaptor SH3BGRL drivesautophagy-mediated chemoresistance through promoting PIK3C3 translation andATG12 stability in breast cancers”的研究論文,該研究揭示了一個小分子接頭蛋白SH3BGRL可以通過結合核糖體蛋白促進自噬相關基因的蛋白翻譯效率,從而促進乳腺癌細胞的中度自噬而導致乳腺癌細胞對化療耐藥的機制。
細胞通過自噬可以降解細胞內長壽命蛋白、蛋白聚合物以及受損細胞器來調控和維持細胞的穩態,它還可以通過限制炎癥、清除有毒的未折疊蛋白,除去生成活性氧簇(可損害DNA)的受損線粒體來抑制腫瘤早期形成。一旦失去這種保護性措施將促使癌癥發生,腫瘤細胞中的適度自噬往往促進腫瘤細胞的存活和抗逆功能,進而導致腫瘤細胞耐藥,由此說明細胞自噬在腫瘤發生、發展過程中具有兩面性。目前,對于腫瘤細胞中所存在的內在的自噬發生機制或者直接的驅動基因仍然還很不清楚。
在這項研究工作中,研究團隊首先基于臨床樣本分析發現SH3BGRL無論是在RNA水平還是蛋白水平在高達40-60%的乳腺癌樣本中高表達,而且與患者的不良預后和化療耐藥相關。基于SH3BGRL是一個簡單的接頭蛋白特征,研究者通過蛋白互作的質譜分析發現SH3BGRL在腫瘤組織樣品和細胞中均可以結合大量核糖體亞基蛋白,進而通過多聚核糖體譜(poly-ribosome profiling)結合RNA測序分析發現,SH3BGRL表達變化可以引起普遍的mRNA翻譯效率改變;研究進一步發現,在翻譯改變的基因當中,與自噬起始相關基因PIK3C3的翻譯效率急劇增加。此外,SH3BGRL還可以結合另一個自噬起始基因相關蛋白ATG12,抑制其泛素化降解,從而促進了腫瘤細胞的自噬水平。當在SH3BGRL過表達的細胞中通過敲除PIK3C3或ATG12可以阻止SH3BGRL引起的細胞自噬以及腫瘤細胞對doxorubicin等化療藥物的耐藥性;而敲降SH3BGRL可以降低細胞的自噬水平,增加對這些化療藥物的敏感性。
本研究首次證實一個小分子連接蛋白可以通過結合到核糖體復合物來調節核糖體對mRNA翻譯的效率特性而促進腫瘤細胞中與腫瘤細胞自噬發生相關基因在翻譯水平上的上調表達,為進一步研究核糖體構成(組成)蛋白對mRNA翻譯的選擇性提供了前期基礎,并解析了乳腺癌細胞內在的化療耐藥機制,為克服先天性腫瘤細胞耐藥提供了潛在的檢測和治療藥物靶點(圖釋)。
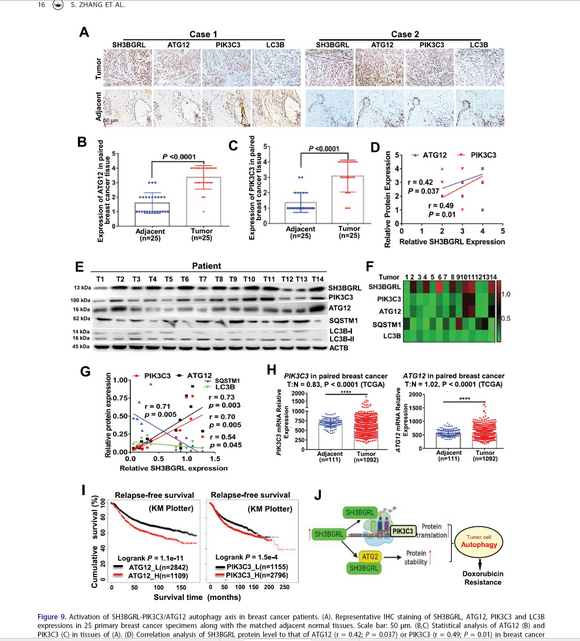
圖:SH3BGRL-PIK3C3/ATG12通路活化導致乳腺癌細胞化療耐藥的機制
同樣地,研究團隊還揭示該小分子接頭蛋白SH3BGRL在翻譯水平上抑制腫瘤細胞粘附蛋白PFN1在翻譯水平上的表達,從而促進腫瘤細胞轉移的特性(Oncogene,2021,Sep; 40(38): 5677-5690;2020 IF:9.867);他們還發現SH3BGRL可以和乳腺癌細胞膜上的HER2蛋白受體結合,從而不依賴生長因子激活并穩定細胞膜上的HER2引起HER2靶向治療的先天性耐藥(J Exp Clin Cancer Res. 2020 May 7;39(1):81;2020 IF:11.161)。
中山大學附屬第一醫院和中山大學中山醫學院聯合培養的博士研究生張邵陽為本研究的第一作者,中山大學附屬第一醫院轉化醫學中心楊蜀嵐研究員和中山大學中山醫學院王海河教授為本文的共同通訊作者。本工作得到了國家自然科學基金和廣東省自然科學基金項目支持,同時得到教育部組織工程與干細胞科研平臺的大力支持。