
中大新聞網訊(通訊員趙萌)目前,面對血液惡性腫瘤、再生障礙性貧血和地中海貧血等骨髓衰竭性疾病,造血干細胞移植(HSCT)已被證實是有效的治療手段,也是核輻射損傷的唯一治療手段。這是因為干細胞具有極強的長期自我更新及多項分化潛能,但仍有5-20%的患者會發生原發或繼發性造血干細胞植入不良,影響最終的治療效果。因此,研究導致植入不良的主要機制將有助于進一步提高治療成效。
近日,中山大學中山醫學院趙萌教授和孫逸仙紀念醫院蔣琳加研究員聯合帶領的團隊在Blood期刊上發表了文章“The RIG-I-NRF2 axis regulates the mesenchymal stromal niche for bone marrow transplantation”,研究論文揭示了骨髓間充質干細胞(MSC)調控造血干細胞移植的新機制。
此前研究表明,骨髓微環境損傷是導致植入不良的主要機制之一。間充質干細胞作為骨髓微環境的重要細胞組成,是具有成骨、成脂肪和成軟骨分化能力的成體干細胞,同時,還具有支持造血干細胞的功能。因此,間充質干細胞被廣泛應用于臨床細胞治療。
趙萌教授團隊認為探討間充質干細胞調控造血干細胞植入不良的機制,具有重要的基礎和臨床意義。臨床研究發現,藥物處理、感染和炎癥反應等刺激因素與造血干細胞植入不良密切相關,然而這些刺激因素導致骨髓微環境損傷進而影響造血干細胞植入不良的機制還不清楚。
趙萌教授研究團隊系統研究了RIG-I-NRF2信號通路對骨髓間充質干細胞成骨分化和支持造血重建功能的調控作用和分子機制,并進一步證實骨髓間充質干細胞的RIG-I-NRF2信號是調控造血干細胞移植后應急髓系分化(Emergency myelopoiesis)抵抗細菌感染的關鍵機制。
RIG-I維甲酸誘導基因-I(retinoic acid-inducible gene I)最初是在維甲酸(ATRA)誘導白血病分化治療研究中發現的維甲酸上調基因。此次研究發現,維甲酸、干擾素、細菌感染等刺激可以在間充質干細胞中顯著上調RIG-I基因的表達,導致間充質干細胞的成骨分化能力受損,從而誘發骨質疏松癥,并且還會損傷間充質干細胞的造血支持功能,進而導致造血干細胞移植后的植入不良和移植后的細菌感染等并發癥。
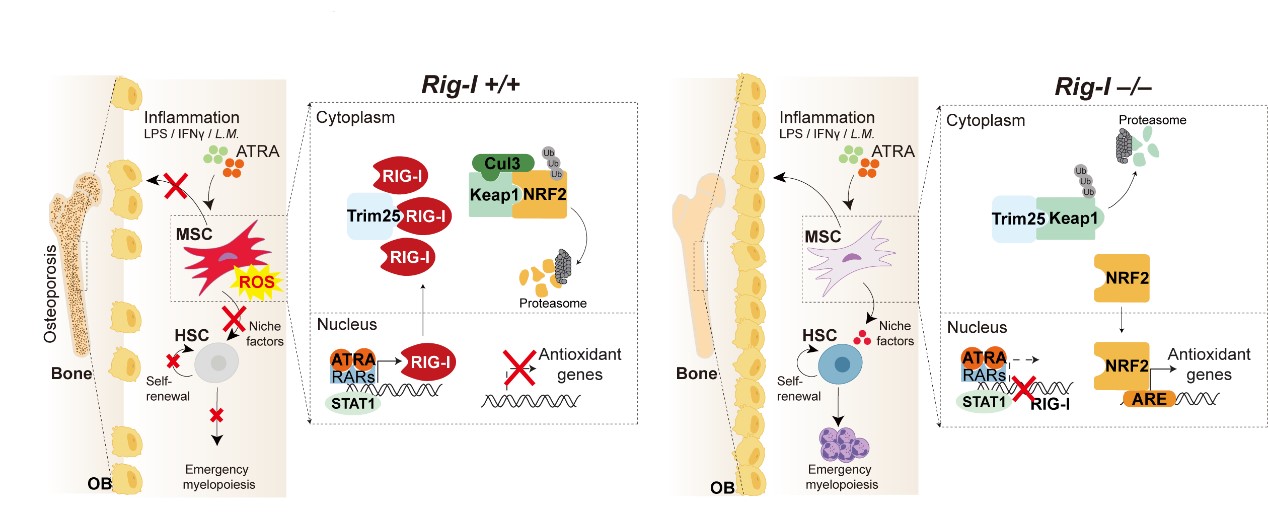
骨髓間充質干細胞RIG-I-NRF2通路調控造血干細胞移植
研究還證實,RIG-I通過降解細胞抗過氧化分子NRF2導致細胞過氧化物增加是損傷間充質干細胞的關鍵。此發現與移植后患者的臨床轉化研究相一致,提示對骨髓微環境的抗氧化干預是治療移植后植入不良和細菌感染等并發癥的有效手段,能夠有效緩解在藥物和感染刺激條件下因MSC損傷所導致的骨質疏松癥和造血、免疫功能障礙。
此外,研究團隊還發現恢復MSC的成骨分化能力并不能有效的恢復其造血支持能力,表明MSC成骨分化和造血支持可能是由不同功能亞群介導,因此進一步解析MSC參與成骨分化和造血支持不同功能亞群的調控機制和制備策略,將為開發針對不同適應癥的MSC細胞治療藥物奠定基礎。
趙萌教授和蔣琳加研究員為本文的共同通訊作者,婁琪博士后、蔣凱證碩士研究生和許泉輝八年制博士研究生為本文的共同第一作者。本項目得到了基金委優秀青年基金、干細胞重點研發項目和中山大學中山醫學院-附屬第一醫院先進醫學科學技術研究中心的支持。