
中大新聞網訊(通訊員王小廠)創傷后應激障礙(post-traumatic stress disorder, PTSD)是個體在經歷重大威脅性事件或嚴重精神創傷而出現的應激相關障礙,是精神刺激所致精神損傷的典型代表。隨著經濟社會的發展,精神損傷相關案件日益增多,訴訟雙方對傷病關系、損傷因素參與度等鑒定意見經常存在質疑。由于PTSD的發病機制仍不清楚,鑒定技術缺少客觀的生物學指標,同時還可能受到詐病的影響,精神損傷相關司法鑒定仍是法醫學的難題。
恐懼記憶的過度泛化是PTSD 核心癥狀的發生基礎,讓個體不能有效地預測威脅,還將中性甚至安全線索均視為危險信號,導致時時“杯弓蛇影”、處處“草木皆兵”。目前恐懼記憶泛化的發生機制仍然不清楚。近日,中山大學法醫鑒定中心趙虎教授科研團隊從TET-3介導的DNA去甲基化的角度,闡釋了應激誘導恐懼記憶泛化的表觀遺傳機制,在知名期刊 Brain Pathology(中科院期刊分區 醫學 1區)發表題為“Deficiency of Tet3 in nucleus accumbens enhances fear generalization and anxiety-like behaviors in mice”的研究論文。
該工作揭示了大腦神經元TET 家族最豐富的 DNA 去甲基化酶TET3,可感知外在環境應激,并將神經可塑性與恐懼泛化過程中的行為適應聯系起來。他們發現足部電擊強度依賴性地誘導小鼠恐懼泛化和伏隔核 (NAc) 的TET3 表達,而對TET1和TET2的表達沒有影響。通過在 NAc灌注抑制劑或 AAV-Tet3-shRNA 病毒來抑制 DNA 去甲基化可增強恐懼泛化和焦慮樣行為。值得關注的是,TET3的下調使溫和應激下本應形成特異性恐懼記憶轉向泛化,提示TET3介導的去甲基化調控了PTSD的易感性。TET3 下調可損害神經元結構可塑性,降低 DNA 羥甲基化 (5hmC),降低突觸可塑性相關基因Homer1等的表達,有趣的是,免疫相關基因 B2m等的表達卻增加。進一步研究發現,下調TET3激活小膠質細胞和 CD39-P2Y12R 信號通路,而抑制 CD39可逆轉 TET3 敲低對恐懼泛化和焦慮的影響。最后,通過CRISPR-Cas9過表達 TET3 可逆轉恐懼泛化和焦慮樣行為。
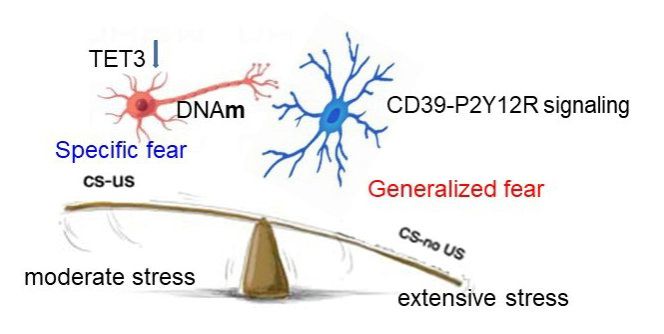
TET-3介導的DNA去甲基化表觀遺傳機制調控恐懼記憶泛化
該工作揭示了TET-3介導的表觀遺傳機制將個體經歷和創傷暴露融入個體的遺傳背景,以引發一系列不同的恐懼反應。中山醫學院范卜方博士及郝博博士為論文的共同第一作者。王小廣副教授及趙虎教授為論文的共同通訊作者。該工作是在國家自然科學基金重點項目和廣東省自然科學基金重點項目等資助下,在近年來一系列研究發現的基礎上取得的最新進展。
論文鏈接:https://doi.org/10.1111/bpa.13080