
中大新聞網訊(通訊員王志勇)在免疫微環境中,癌細胞通過特殊抗原的表達形式抑制T細胞TCR-pMHC通路的信號轉導,導致T細胞休眠或耗竭。激活并增強患者自身免疫系統,實現對癌癥的識別和防御成為亟待解決的難題。近期研究表明,雙特異性靶向抗體(BsAb)可連接T細胞和靶標癌細胞,進而激活T細胞對癌細胞的識別作用并誘發特異性殺傷。
為了維持BsAb在體內的效應濃度以發揮療效,中山大學材料科學與工程學院王志勇副教授團隊構建了一類硅基介孔摻錳納米體系,聯合影像引導,將編碼了BsAb基因序列的微環DNA(MCDNA)精準遞送到體內特定部位,實現BsAb在體內的生物合成和分泌,并針對動物模型初步完成長效癌癥免疫治療(圖1)。利用膠束/前驅體法制備的硅基介孔納米棒MSN體系,在沉積錳氧化物后形成了硅基介孔摻錳納米棒Mn-MSN,具備MRI-T1可視化的磁學功能。此外,利用孔道空間負載部分核酸,協同棒狀結構的高縱橫比特點,可實現體內細胞物理“穿刺”,有效促進核酸藥物進入胞內。轉染兩天后,可在BsAb基因遞送組的小鼠血液組織中檢測到高水平的抗體分泌濃度,達到1-2μg/L,并有效持續5天。荷瘤小鼠抗癌實驗證實,BsAbs的持續分泌可有效提高腫瘤微環境中CD3+ 和CD8+ T細胞的浸潤比例,促進免疫細胞分泌IFN-γ、TNF-α和IL-2因子;同時Mn-MSN體系代謝生成的Mn2+ 可觸發cGAS-STING信號通路上調,輔助免疫治療。經兩種“冷免疫”腫瘤模型驗證,Mn-MSN介導的雙特異性靶向抗體表達均可誘發強烈的免疫應答,延緩腫瘤生長。這種硅基介孔摻錳納米棒/MCDNA遞送系統是具有前景的基因遞送系統,它將為基于抗體的癌癥免疫治療提供一種新的給藥方式。
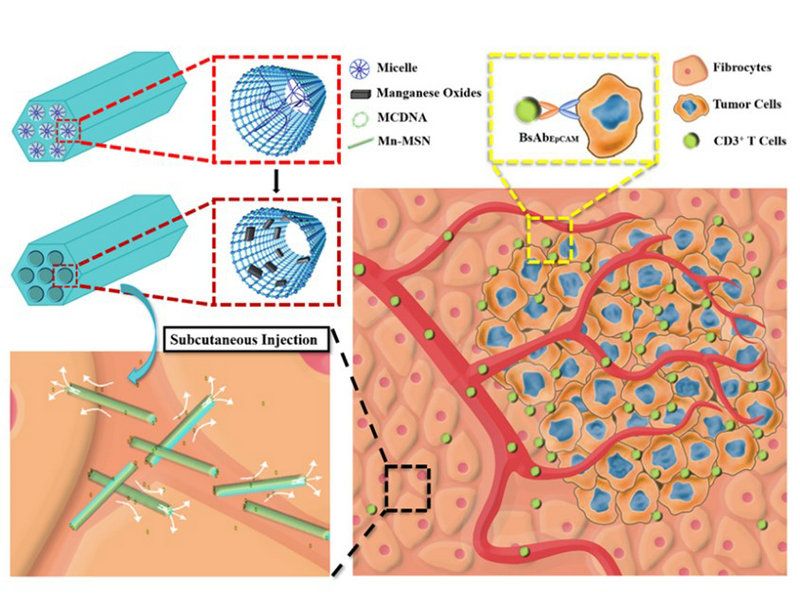
圖1 一種基于納米棒的新型免疫調節納米平臺。在磁共振成像引導下,高縱橫比納米棒和細胞間存在界面刺激作用,協助雙特異性靶向抗體編碼微環DNA的體內遞送
以上成果以“Manganese-doped Biostimulatory Nanoneedle for MRI-Visual Bispecific Antibody Gene Delivery and Immunosuppression Reversal as a Cancer Immunotherapy Strategy”為題,于近日發表于Chemical Engineering Journal。中山大學材料科學與工程學院為第一完成單位。文章的第一作者是2019級博士研究生蔡鎵鸝,中山大學材料科學與工程學院王志勇副教授、中山大學孫逸仙紀念醫院肝膽外科徐鋆耀副教授和陳國創博士為共同通訊作者。該工作得到了廣東省基礎與應用基礎研究基金的資助,以及聚合物復合材料及功能材料教育部重點實驗室、廣州市柔性電子材料與可穿戴設備重點實驗室的支持。