
中大新聞網訊(通訊員毛宗萬)隨著金屬免疫學的興起,鋅離子被發現在致癌和免疫調節中起著關鍵作用。然而,關于能夠觸發Zn2+介導的免疫反應的抗腫瘤化合物的報道很少。近日,中山大學化學學院毛宗萬教授團隊設計開發了一種新的環金屬化的Pt(IV)-三噻吩復合物, 它在誘導DNA損傷的同時破壞了腫瘤細胞的鋅穩態,導致了細胞質Zn2+的過量積累和氧化還原失衡,最終誘導細胞焦亡和細胞骨架重塑,進而激活體內強大的抗腫瘤免疫反應。這是首例報道的調節鋅穩態以激活抗腫瘤免疫的金屬復合物,提示鋅穩態藥物在癌癥化學免疫治療中具有巨大潛力。
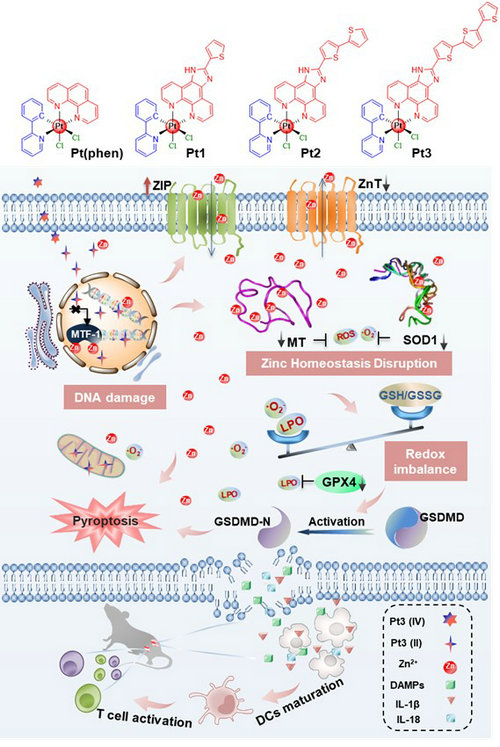
圖1. 三噻吩修飾的新型鉑(IV)配合物的設計及其在誘導DNA損傷的同時破壞鋅穩態、進而誘導細胞焦亡并激活抗腫瘤免疫響應的機制示意圖。
作用機制研究發現,Pt(IV)-三噻吩復合物具有中等強度的鋅離子親和力,能夠誘導細胞中鋅調節蛋白(如負責鋅轉運和外泌的蛋白ZIP/ZnT,金屬硫蛋白MT、鋅感應元件結合轉錄因子MTF-1)的轉錄和表達水平發生異常 ,進而導致細胞質中Zn2+的過量積累和氧化還原失衡,包括Cu/Zn超氧化物歧化酶(SOD1)的下調、超氧化物陰離子和脂質過氧化物的過量積累、谷胱甘肽過氧化物酶4(GPX4)的失活等。有趣的是,Pt(IV)-三噻吩復合物對鋅穩態和氧化還原穩態的同時破壞激活了gasdermin-D介導的細胞焦亡并伴隨細胞骨架重塑,從而對三陰性乳腺癌細胞MDA-MB-231表現出納摩爾水平(~ 0.11 mM)的細胞毒性,釋放的促炎細胞因子促進了樹突狀細胞成熟和T細胞腫瘤浸潤,最終不僅消除了體內的原發腫瘤,也消除了遠處腫瘤。
相關成果發表在Angewandte Chemie International Edition,文章的第一作者是中山大學化學學院博士生蘇緒賢,曹乾副教授和毛宗萬教授為該論文的共同通訊作者。該工作得到了國家自然科學基金重點項目、面上項目以及廣東省自然科學基金面上項目的資助。