
中大新聞網訊(通訊員文朝陽、陳鋆、鄭敏珊)2025年5月30日,腫瘤防治中心康鐵邦、武遠眾團隊在國際期刊《科學》發表了題為“ASB7是H3K9me3表觀遺傳的負向調控分子”的研究論文。研究揭示了ASB7擴增導致基因組不穩定并賦予腫瘤對PARPi敏感性,未來或可能為ASB7擴增型腫瘤患者提供新的治療方向。
研究團隊通過全基因組范圍的CRISPR-Cas9遺傳學篩選,發現E3泛素連接酶ASB7是H3K9me3的核心負調控因子。在調控機制上,H3K9me3的閱讀器HP1可招募ASB7至異染色質區域降解SUV39H1,這一過程受到細胞周期激酶CDK1-Cyclin B1嚴密控制,進入有絲分裂M期后,CDK1磷酸化ASB7并阻斷其對SUV39H1的泛素化降解,保障了H3K9me3在隨后細胞周期中的重建。該研究表明,在哺乳動物體細胞(含腫瘤細胞)中,“讀-寫-降解”平衡,而非經典的“讀-寫-擦除”平衡,可能是H3K9me3維持表觀遺傳穩態的基本機制。
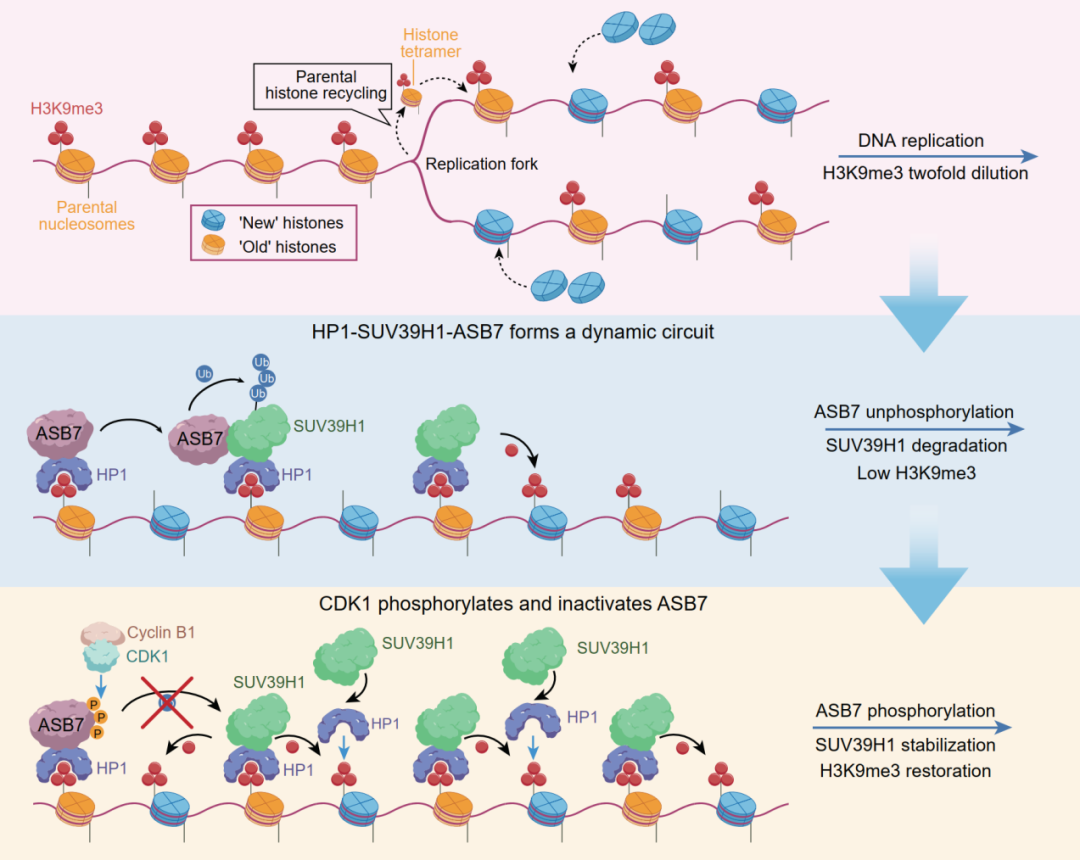
圖1. HP1-SUV39H1-ASB7介導的“讀-寫-降解”平衡控制H3K9me3表觀遺傳
DNA雙鏈斷裂損傷位點會發生H3K9me3修飾,進而激活下游級聯損傷修復通路。ASB7在多種腫瘤中呈現擴增狀態,這導致雙鏈斷裂位點的H3K9me3修飾水平不足,進而引起同源重組修復受損。細胞及動物實驗表明,ASB7高表達增強了腫瘤細胞對PARP抑制劑的敏感性。結果提示,ASB7擴增型腫瘤患者可能是PARP抑制劑的潛在獲益人群。
原文鏈接:https://www.science.org/doi/10.1126/science.adq7408?sessionid=511868241