
中大新聞網(wǎng)訊(通訊員馮敏)近日,中山大學(xué)藥學(xué)院馮敏教授課題組與海南大學(xué)藥學(xué)院郭羚教授合作在精準(zhǔn)調(diào)控巨噬細(xì)胞逆轉(zhuǎn)肝衰竭研究中取得重要進(jìn)展,在Cell Reports Medicine以研究長文的形式發(fā)表題為“Artificial cells delivering itaconic acid induce anti-inflammatory memory-like macrophages to reverse acute liver failure and prevent reinjury”的研究論文。
病毒感染或藥源性副作用是引發(fā)致命性肝衰竭的主要原因。目前肝移植是治療非逆轉(zhuǎn)性肝衰竭的有效方法,但供體肝臟短缺、錯(cuò)過移植最佳時(shí)期以及長期免疫抑制等不良反應(yīng)極大地限制了肝移植的適用性。因此,尋求拯救肝衰竭、并長效保護(hù)肝功能的治療方案具有重要意義。巨噬細(xì)胞在肝衰竭疾病進(jìn)展中發(fā)揮著關(guān)鍵調(diào)節(jié)作用,適度巨噬細(xì)胞免疫反應(yīng)有利于壞死細(xì)胞的清除和組織穩(wěn)態(tài)的恢復(fù),然而其過度反應(yīng)則誘發(fā)炎癥風(fēng)暴,驅(qū)動(dòng)暴發(fā)性肝衰竭導(dǎo)致多器官衰竭,死亡率高。靶向調(diào)節(jié)巨噬細(xì)胞抗炎功能并誘導(dǎo)其產(chǎn)生穩(wěn)態(tài)記憶有望成為治療肝衰竭疾病的高效且長效手段。
研究團(tuán)隊(duì)基于肝衰竭病理特征,設(shè)計(jì)了一款負(fù)載衣康酸的人工治療細(xì)胞AI-Cells(圖1)。AI-Cells模擬凋亡細(xì)胞的拓?fù)浣Y(jié)構(gòu)和細(xì)胞膜組成,成功實(shí)現(xiàn)了對(duì)肝巨噬細(xì)胞的精準(zhǔn)捕獲。并通過干擾NLRP3炎癥小體的自組裝調(diào)控肝巨噬細(xì)胞使其恢復(fù)穩(wěn)態(tài);同時(shí)誘導(dǎo)抗炎記憶樣巨噬細(xì)胞產(chǎn)生,進(jìn)而對(duì)急性肝衰竭和肝再損傷產(chǎn)生了良好的治療作用。
為實(shí)現(xiàn)對(duì)肝巨噬細(xì)胞的精準(zhǔn)識(shí)別和智能調(diào)控,研究團(tuán)隊(duì)將脂質(zhì)雙分子膜控技術(shù)與細(xì)胞仿生原理相結(jié)合,構(gòu)建了高效捕獲巨噬細(xì)胞的人工治療細(xì)胞AI-Cells,其原理為:AI-Cells粒徑大于肝竇內(nèi)皮細(xì)胞窗口,導(dǎo)致其難以穿梭進(jìn)入狄氏腔,避免了非靶細(xì)胞分布;AI-Cells膜嵌合磷脂酰絲氨酸,此“Eat me”信號(hào)增強(qiáng)巨噬細(xì)胞對(duì)其識(shí)別作用;AI-Cells獨(dú)特的表面拓?fù)浣Y(jié)構(gòu)顯著提升巨噬細(xì)胞吞噬作用。上述三重作用共同介導(dǎo)對(duì)肝巨噬細(xì)胞的精準(zhǔn)識(shí)別和調(diào)控。
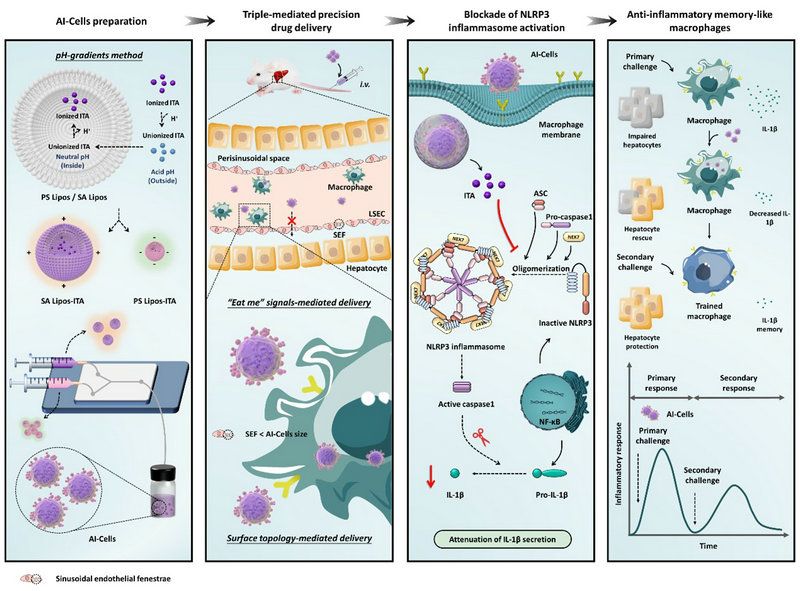
圖1 AI-Cells精準(zhǔn)調(diào)控巨噬細(xì)胞逆轉(zhuǎn)肝衰竭并預(yù)防肝再損傷的工作原理
研究團(tuán)隊(duì)著眼于巨噬細(xì)胞與肝細(xì)胞的交互作用,揭示IL-1β(而非TNF-α和IL-6)是AI-Cells起效的關(guān)鍵因子:AI-Cells通過阻斷巨噬細(xì)胞內(nèi)NLRP3炎癥小體自組裝來下調(diào)Caspase p20,進(jìn)而調(diào)控IL-1β表達(dá),發(fā)揮逆轉(zhuǎn)肝細(xì)胞損傷的作用。并且發(fā)現(xiàn)AI-Cells可誘導(dǎo)抗炎記憶樣巨噬細(xì)胞,具備預(yù)防肝再損傷的能力。僅一次給藥,AI-Cells即可在數(shù)周內(nèi)有效幫助肝衰竭治療后的動(dòng)物模型抵御3次肝再損傷。綜上所述,AI-Cells可高效逆轉(zhuǎn)肝衰竭,并長效保護(hù)其免受再次損傷,該人工細(xì)胞治療設(shè)計(jì)具備臨床轉(zhuǎn)化潛力,未來或可成為肝移植的替代方案。
中山大學(xué)藥學(xué)院博士研究生尹娜為該論文的第一作者,碩士研究生張文君為第二作者,中山大學(xué)馮敏教授和海南大學(xué)郭羚教授為共同通訊作者。該研究得到了國家自然科學(xué)基金、廣東省基礎(chǔ)與應(yīng)用基礎(chǔ)研究基金、海南省自然科學(xué)基金的資助。
論文鏈接:https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(23)00260-4