
中大新聞網訊(通訊員舒崖清)近日,中山大學附屬第三醫院腦病中心邱偉等聯合中國科學院精密測量科學與技術創新研究院王杰、香港中文大學劉曉東教授在神經科學知名期刊Journal of Neuroinflammation上發表了題為“Transfer of patient's peripheral blood mononuclear cells (PBMCs) disrupts blood–brain barrier and induces anti-NMDAR encephalitis: a study of novel humanized PBMC mouse model”的研究論文。中山大學附屬第三醫院舒崖清、彭富華為共同第一作者,邱偉、王杰、劉曉東為共同通訊作者。該研究得到了中山大學中山醫學院王琴、中山大學附屬第一醫院馮慧宇、華南農業大學孫堅、德國Borstel研究中心余新華教授指導。
自身免疫性腦炎是一種中樞免疫性疾病,2018年被國家罕見病目錄納入,其中抗N-甲基-D-天冬氨酸受體(NMDAR)腦炎最為常見,其病因及發病機制不詳,部分患者預后差,給家庭和社會帶來沉重負擔。聚焦抗NMDAR腦炎發病機制,尋找治療靶點尤為迫切。
該研究首次構建了PBMC誘導的人源化小鼠模型:課題組分別將抗NMDAR腦炎患者、健康受試者的PBMC(外周血單核細胞)通過腹腔注射至重度免疫缺陷小鼠-BRGSF小鼠中(圖1A),人源的免疫細胞可以在小鼠的血、脾、骨髓中存活(圖1B),小鼠脾臟形成類似于生化中心的結構(圖1C)。而且,實驗模型小鼠的血、腦脊液中有抗NMDAR抗體(抗GLuN1抗體)產生(圖1D-F),模型小鼠腦組織中GLuN1表達下調(圖1G,H);進一步行為學檢測還發現模型小鼠精神行為存在異常(圖1I);通過9T功能MRI成像也顯示實驗模型小鼠腦功能紊亂和腦結構輕度萎縮(圖1J)。
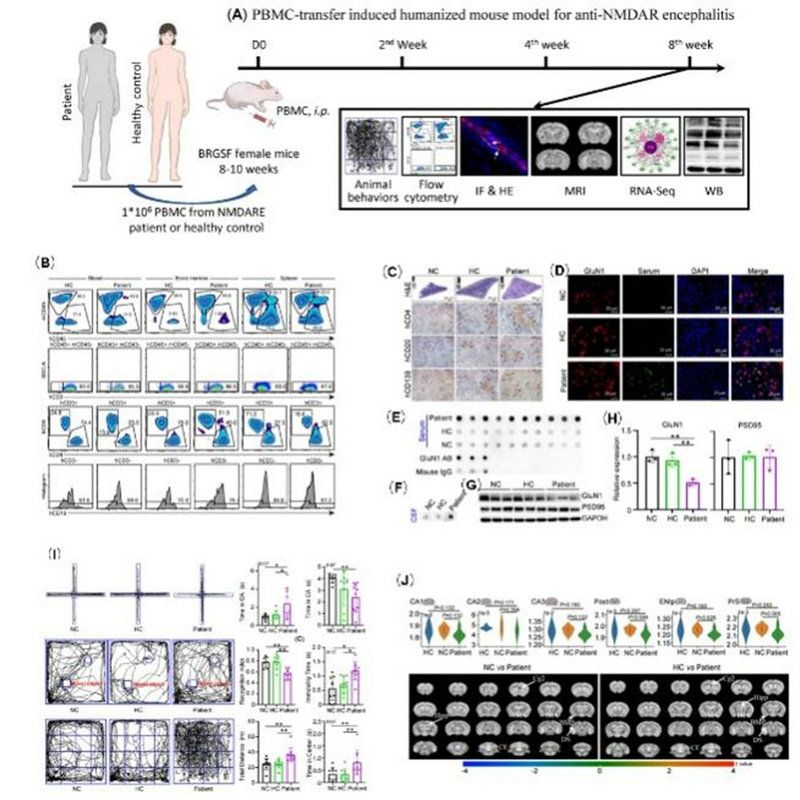
圖1:PBMC誘導人源化抗NMDAR腦炎小鼠模型
該研究發現,模型小鼠存在明顯的血腦屏障(BBB)破壞及緊密連接蛋白如Claudin-1\Occludin\ZO-1\Claudin-5蛋白下調(圖2A-C);并發現模型小鼠腦膜中有人B細胞、人T細胞浸潤(圖2D),且模型小鼠海馬存在CD8+T細胞浸潤(圖2E)。
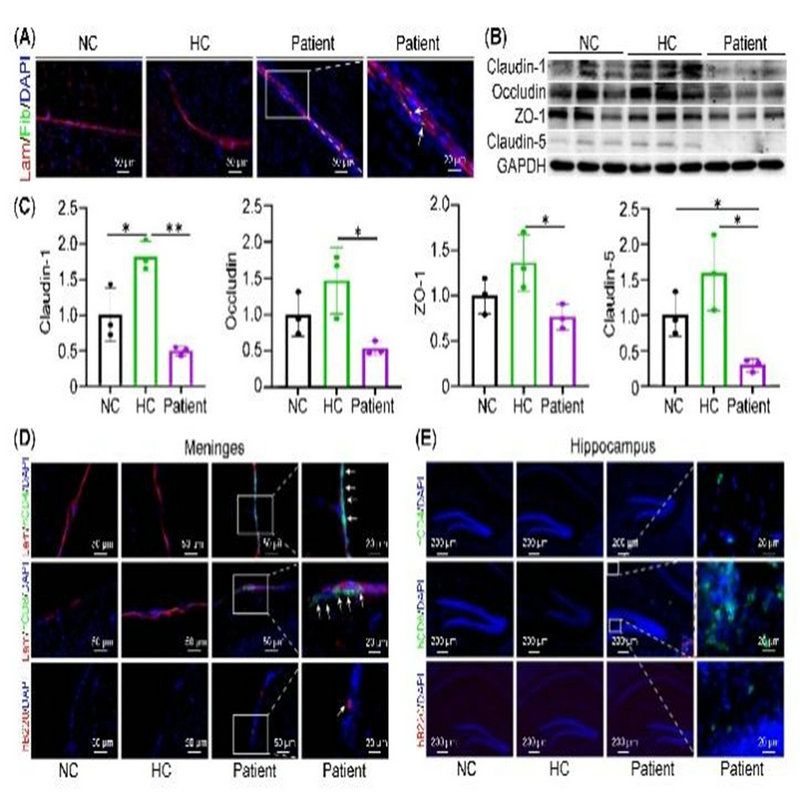
圖2:模型小鼠存在BBB破壞及人免疫細胞浸潤中樞
該研究進一步發現,PBMC通過上調BBB內皮細胞IL-1β表達以促進BBB的破壞。研究人員通過轉錄組學、免疫熒光、蛋白印跡等鑒定了PBMC通過上調IL-1β介導模型小鼠BBB破壞(圖3A-J),并在體外BBB模型中對內皮細胞 Il-1β 進行敲除也發現敲除 Il-1β 后BBB破壞明顯減輕(圖3K-O)。
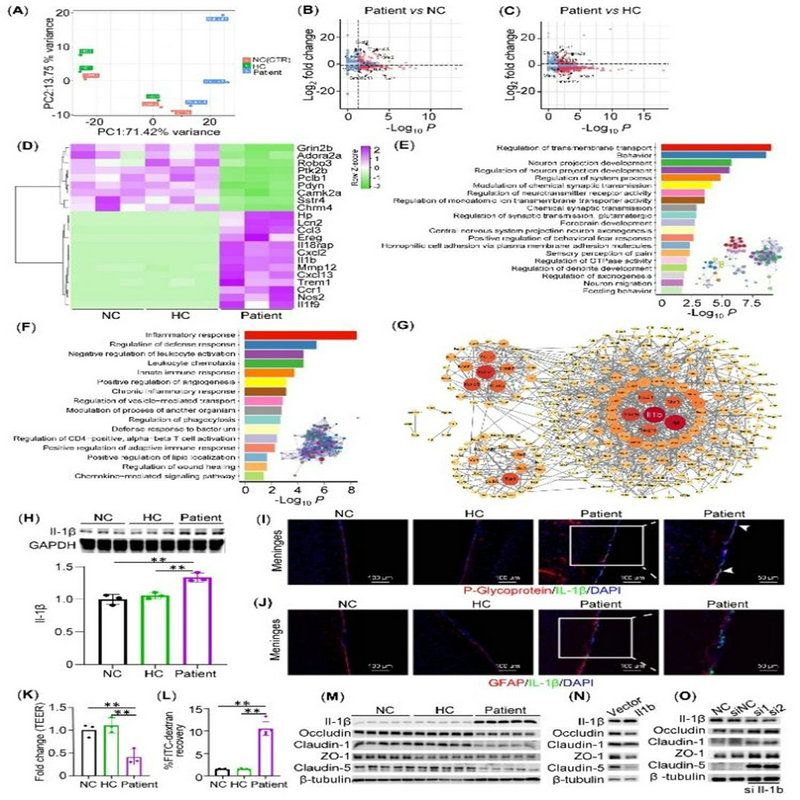
圖3:體內、體外實驗揭示內皮細胞IL-1β參與BBB的破壞
最后,該研究明確了IL-1受體拮抗劑(Anakinra, 阿那白滯素)對BBB的保護作用并可緩解模型小鼠的病情。課題組首次發現,在體外BBB模型上,Anakinra上調緊密連接蛋白ZO-1\Occludin\Claudin-5表達(圖4B)及緩解患者PBMC對BBB模型完整性的破壞(圖4C,D);在抗NMDAR腦炎人源化模型小鼠上也發現Anakinra可以改善小鼠的精神行為異常(圖4E-G)、上調腦組織緊密連接蛋白以及海馬組織中GluN1的表達(圖4H-J)。
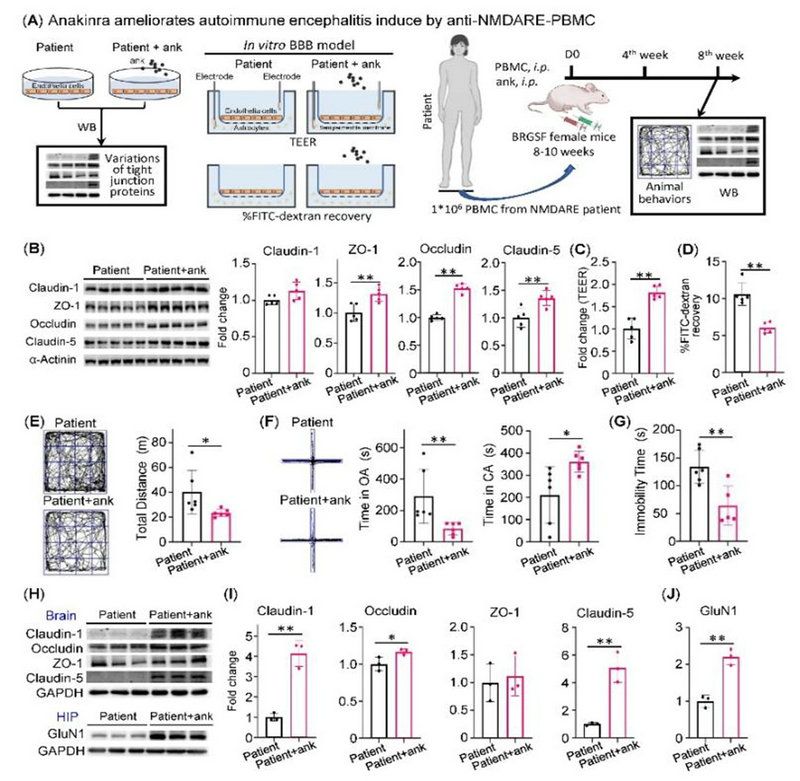
圖4:體內、外實驗證實了IL-1受體拮抗劑(Anakinra)對BBB的保護作用
本研究首次構建了PBMC誘導的人源化抗NMDAR腦炎小鼠模型,并進一步從體內、體外實驗揭示PBMC通過上調IL-1β促進BBB的破壞進而誘導模型小鼠腦炎發生。該研究不僅闡明了抗NMDAR腦炎潛在的發病機制,也為抗NMDAR腦炎的精準治療提供了新的靶點,并為下一步開展Anakinra藥物臨床試驗奠定了理論基礎。
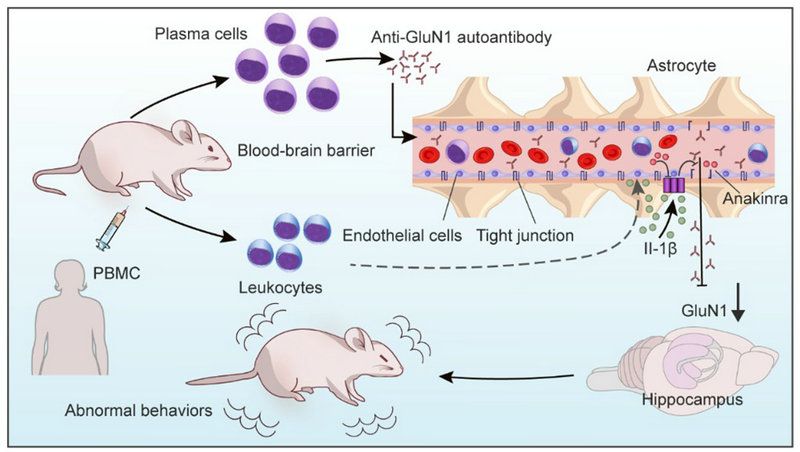
圖5:文章概括圖
近年來,邱偉、舒崖清課題組一直致力抗NMDAR腦炎等自身免疫腦炎的臨床與基礎研究,從疾病的遺傳病因學、臨床標記物等多個角度進行了深入探討,取得了一系列成果。課題組于2019年首次發現中國抗NMDAR腦炎患者的易感基因HLA_DRB1*16:02,相應成果發表在國際知名雜志JNNP雜志上(Journal of Neurology, Neurosurgery, and Psychiatry. 2019)。此外,課題組還發現IRF7,BANK1,TBX21等多個易感基因(European Journal of Neurology. 2021)。課題組還系統地研究了抗NMDAR腦炎的生物標志物在臨床上的作用,包括焦亡關鍵蛋白Gasdermin D (Journal of Neurochemistry. 2021)、神經纖維絲輕鏈(Journal of Neurochemistry.2023;Neurological Sciences. 2022)、CD40/CD40L(Journal of Neuroimmunology.2022)、胱抑素C(Journal of Neuroimmunology. 2022;Acta Neurologica Scandinavica. 2018)、補體(European Journal of Neurology. 2018)等,上述生物標志物與病情嚴重程度、治療反應等相關,成為臨床上評估患者病情的指標。
未來,腦病中心神經免疫團隊將繼續加強與中國科學院精密測量科學與技術創新研究院王杰、香港中文大學劉曉東等國內外科研機構研究者的合作與交流,促進神經免疫亞專科的科研達到國內領先、國際一流水平。