
中大新聞網訊(通訊員鄭雙佳、萬園園、楊躍東)蛋白降解靶向嵌合體(PROTACs)作為一種新興的治療策略,通過招募泛素-蛋白酶體系統降解致病靶蛋白,具有攻克“不可成藥”靶點的巨大潛力。然而,PROTAC分子三元組結構特性導致其較高的分子量進而使其成藥性的優化變得極具挑戰。國家超算廣州中心副總工楊躍東教授團隊聯合星藥科技研發團隊,依托“天河二號”憑借其在超算、AI和生物制藥的交叉研究及深度融合的經驗,充分結合基于強化學習的分子生成和基于物理的分子模擬技術,在短短49天內就發現了具有高降解活性及高藥代性能的新型先導化合物,并完成濕實驗驗證。該研究對PROTAC設計以及成藥性優化具有重要意義,相關成果本月正式發表在國際權威期刊Nature Machine Intelligence。
PROTAC聚焦不可成藥靶點 其理性設計充滿挑戰
自2001年首次對蛋白分解靶向嵌合體(PROTACs)進行概念驗證以來,PROTACs已成為通過泛素-蛋白酶體系統選擇性降解靶蛋白的有效工具。由于其特色的雙功能結構,PROTACs有能力同時結合靶蛋白和E3泛素酶,形成一個三元復合物,促進靶蛋白的多泛素化和降解。因此,PROTACs只需要短暫地與目標蛋白結合就能誘導泛素化和降解,這促進了其在“不可成藥靶點”上的應用。然而,PROTAC的設計和優化仍需要基于經驗主義的反復迭代優化,這種開發策略存在嚴重的局限性。
PROTAC設計過程示意圖。圓圈和線條分別代表配體和連接子,象征著智能模型從廣闊的化學空間中提取信息生成一個連接基團將兩個蛋白質拉近的過程。
在PROTACs的開發過程中,最棘手的是如何選擇合適的連接基團形成合適的PROTAC活性三元復合物從而發揮降解活性和靶點選擇性。由于三元結構的復雜性和動態性,連接基團的設計往往是一個艱巨的挑戰。連接基團的長度、組成、柔性、連接位點都會對結果造成巨大影響。另外一個設計挑戰則來自于PROTAC分子往往不符合口服藥物常見的性質。作為一種多組分分子,其較大的分子量導致其相比于傳統小分子有著溶解度差、滲透性差、生物利用度低以及不可預測的Hook效應等問題,從而阻礙了PROTACs的臨床轉化。如何在有限的條件下理性優化PROTAC分子以克服這些缺點,是目前該領域的重大難題。
基于PROTAC-RL優化方法 僅49天發現新型先導化合物
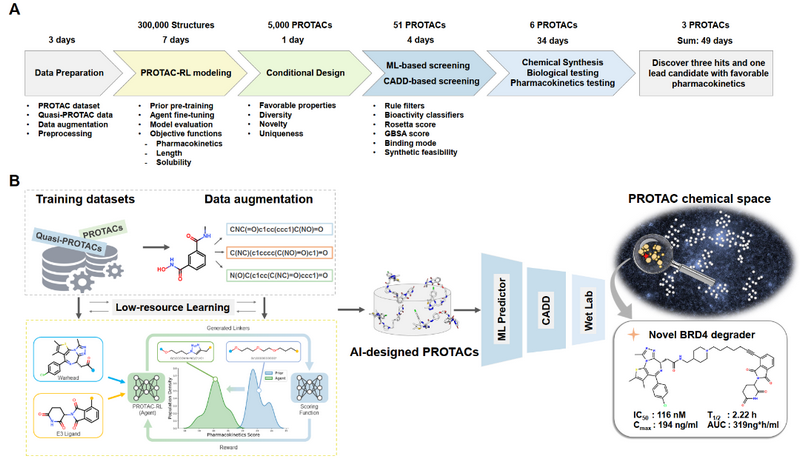
PROTAC-RL流程示意圖
為了解決這一問題,研究團隊提出了一種基于深度生成模型的PROTAC理性設計算法——PROTAC-RL。該模型以一對E3配體和彈頭作為輸入,輸出設計好的連接物,并在強化學習(Reinforcement Learning, RL)的引導下生成具有特定性質的PROTAC分子。作為概念驗證,研究團隊選擇了BRD4作為靶蛋白并生成了5000余個PROTACs,依托超算通過機器學習打分器和分子動力學模擬方法對這些虛擬分子進行了進一步聚類和篩選。
根據合成可及性,研究者最終挑選、合成并實驗測試了6個PROTACs,其中3個顯示了對BRD4的抑制性活性。其中一個先導化合物同時顯示出對腫瘤細胞系的高抗增殖效力,并在小鼠中表現出良好的藥代動力學(如上圖所示)。基于國家超算廣州中心生物醫藥應用平臺、大規模并行分子動力學模擬方法以及用于深度學習模型訓練的海量GPU算力,整個過程僅消耗了49天,證明了超算、深度學習和分子動力學的結合能夠促進高效的理性PROTAC設計和優化。
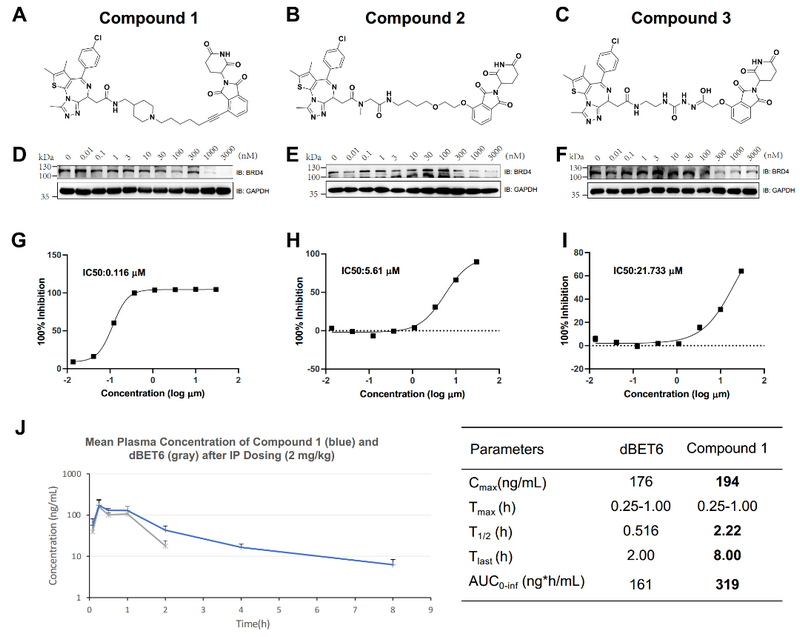
生物活性測試和藥代動力學測試
此次研究推出了一種完全自動化的計算框架,該框架有效結合了強化學習驅動的深度生成模型、機器學習和分子動力學模擬,用于合理地設計和優化PROTACs。在針對BRD4靶點的案例研究中,依托“天河二號”及生物醫藥應用平臺,研究團隊在不到50天的時間內就發現了三個具有良好降解效應的PROTAC分子,其中一個還具有良好的藥代動力學性質,該應用是將超算、人工智能驅動的計算策略與實驗相結合獲得有效候選藥物的典型成果之一。