
干眼(DED)發(fā)病率高達(dá)21-30%,其主要癥狀包括眼干澀、疲勞、疼痛、流淚、異物感、燒灼感等諸多眼部不適,影響患者的工作和生活;嚴(yán)重病變還可引起角膜變薄、潰瘍、瘢痕形成、甚至穿孔,危及患者視力、甚至盲目。干燥壓力(DS)和滲透壓過高等環(huán)境因素會(huì)影響刺激角膜上皮,從而誘發(fā)DED中的眼表免疫炎癥損傷,因此,DED其實(shí)是一種多因素誘發(fā)的自身免疫性眼表疾病。但是上皮細(xì)胞與環(huán)境壓力之間潛在的免疫損傷機(jī)制依然不明確。
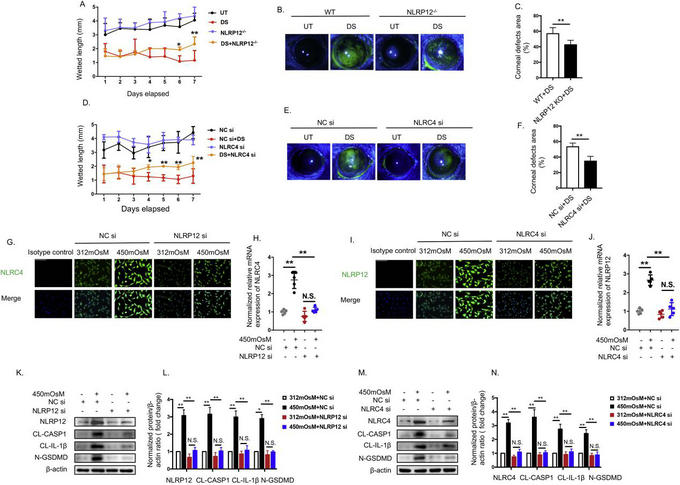
為解答這一重要科學(xué)問題,我校中山眼科中心遲瑋副主任醫(yī)師團(tuán)隊(duì)構(gòu)建了小鼠和人角膜上皮細(xì)胞的干眼模型來模擬干燥和高滲壓力誘導(dǎo)的干眼,深入研究干眼的免疫損傷機(jī)制和關(guān)鍵致病靶點(diǎn)。國際上首次發(fā)現(xiàn)環(huán)境壓力可以促進(jìn)角膜上皮細(xì)胞中的新型炎性小體——NLRC4和NLRP12炎癥小體的組裝、活化,從而誘導(dǎo)GSDMD的切割,引起角膜上皮的焦亡打孔、并伴隨大量炎癥因子(白介素[IL]-1β和IL-33)的釋放;并且NLRC4和NLRP12可以相互協(xié)同放大焦亡的炎癥損傷。研究還首先報(bào)道了細(xì)胞焦亡的新機(jī)制,即焦亡打孔的過程中不僅有經(jīng)典的IL-1β的分泌還伴有大量IL-33釋放,介導(dǎo)角膜上皮細(xì)胞的炎癥損傷。靶向性調(diào)控GSDMD和IL-33的切割、活化可以顯著抑制眼表組織損傷,證實(shí)了其是介導(dǎo)干眼發(fā)病的關(guān)鍵致病靶點(diǎn)。研究不僅揭示了干眼角膜上皮細(xì)胞免疫炎癥損傷的關(guān)鍵機(jī)制,也為干眼的治療提供了新靶點(diǎn)和治療策略。近日,研究論文“NLRP12- and NLRC4-mediated corneal epithelial pyroptosis is driven by GSDMD cleavage accompanied by IL-33 processing in dry eye”發(fā)表在國際知名眼科期刊The Ocular Surface(影響因子12.336)。
論文鏈接:https://www.sciencedirect.com/science/article/pii/S1542012420301087?via=ihub