
近日,我校材料科學與工程學院程度副教授研究組在多功能基因編輯納米載體研究中取得重要突破。該研究以“Codelivery of CRISPR-Cas9 and chlorin e6 for spatially controlled tumor-specific gene editing with synergistic drug effects”為題在線發表在國際綜合學術期刊Science Advances上。
基因編輯技術是新興的基因治療策略,具有簡便易行和低成本的優勢,在基礎研究和臨床治療上都展現出非凡的前景。目前,采用病毒載體傳輸基因編輯元件(編碼CRISPR-Cas9/sgRNA的DNA或mRNA序列)已取得令人矚目的成就,但仍面臨如何提高基因編輯特異性和多功能性的挑戰。非病毒納米載體具有易于大規模制備、易修飾和多功能化的特點,為解決上述問題提供了有效手段。與非病毒載體傳輸質粒DNA或mRNA進行基因編輯相比,非病毒載體直接傳輸Cas9蛋白/sgRNA復合物具有更高的效率和特異性,但其傳輸載體仍較為有限,尤其缺乏多功能載體進行腫瘤組織特異的基因編輯聯合治療。
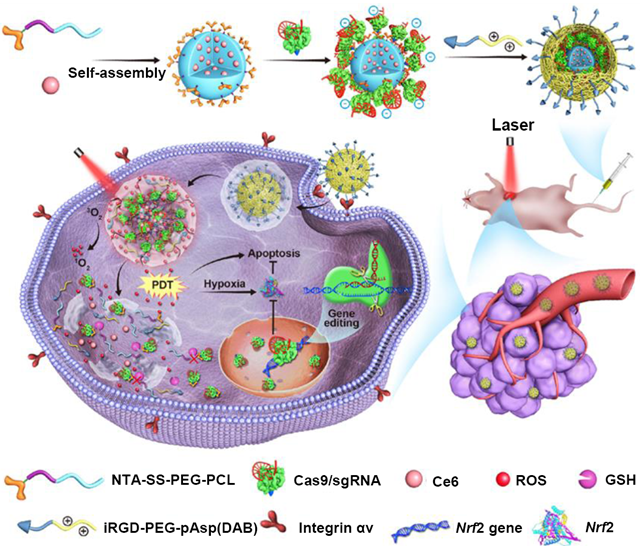
應用直接輸送Cas9蛋白/sgRNA復合物的多功能載體進行腫瘤特異
基因編輯/光動力聯合治療 (Cheng et al., 2020, Sci. Adv.)
針對上述難題,程度副教授團隊開發了一種還原敏感的多功能載體材料(如上圖),載體的疏水性嵌段包載抗腫瘤光動力藥物Ce6,攜帶NTA基團的嵌段則通過NTA和Cas9蛋白末端His標簽之間的特異性結合高效負載Cas9蛋白/sgRNA復合物,然后通過靜電組裝在外層引入靶向腫瘤組織的iRGD分子。這樣的載體結構設計和藥物聯合輸送為實現腫瘤組織特異性的基因編輯和聯合治療提供了可行性。納米藥物靶向輸送至腫瘤細胞后,在近紅外光的輻照下,Ce6產生的活性氧使溶酶體破裂,使納米藥物從溶酶體中逃逸出來,NTA和載體聚合物之間的二硫鍵可響應胞質內的谷胱甘肽等還原劑而斷裂,從而將Cas9蛋白/sgRNA復合物從載體上釋放出來,執行基因編輯功能。在正常的組織中,由于沒有近紅外光的輻照,Cas9蛋白/sgRNA復合物難以從溶酶體中逃逸,無法執行基因編輯的功能。通過紅外光輻照和還原敏感設計實現了腫瘤組織特異的基因編輯。此外,腫瘤細胞在受到Ce6所生成活性氧攻擊時,會上調Nrf2(一種活性氧代謝的關鍵蛋白)的表達,提高腫瘤細胞對活性氧的耐受性。使用靶向Nrf2基因的sgRNA,可以通過聯合輸送的Cas9蛋白/sgRNA復合物使Nrf2基因失活,提高腫瘤細胞對活性氧的敏感性。總而言之,通過多功能載體聯合輸送Ce6和Cas9蛋白/sgRNA復合物,一方面實現了腫瘤特異性的基因編輯,另一方面也實現了基因編輯和光動力治療的聯合治療,協同提高了基因編輯的特異性和治療效果,為基因編輯技術的發展提供了一個新的方向。
該研究工作得到國家重點研發計劃國際合作項目,國家自然科學基金, 廣東省粵港聯合創新、廣東省創新創業團隊項目基金和廣州市產學研專項的資助。我校材料科學與工程學院的程度副教授和哥倫比亞大學的Kam W. Leong教授為本研究的通訊作者,博士生鄧少輝為本研究的第一作者,第一單位為中山大學材料科學與工程學院。
論文鏈接:https://advances.sciencemag.org/content/6/29/eabb4005.full