
3月4日,我校附屬第一醫院神經外科張弩教授團隊在國際知名學術期刊Nature Cell Biology發表題為“Circular RNA-encoded oncogenic E-cadherin variant promotes glioblastoma tumorigenicity through activation of EGFR–STAT3 signalling”的論文,揭示C-E-Cad是膠質瘤干細胞TKI原發抵抗的原因之一,抗C-E-Cad治療有望成為膠質母細胞瘤靶向精準治療的全新方案。
該研究與美國西北大學Feinberg醫學院Shi-Yuan Cheng教授共同合作完成,博士后高辛亞、李凡瀅、博士夏昕、科研助理張茂雷為共同第一作者,附屬第一醫院為第一作者和最后通訊作者單位,文章依托于精準醫學研究院實驗平臺完成。
膠質母細胞瘤(GBM)是中樞神經系統常見的惡性腫瘤之一。EGFR作為重要的驅動基因在約近半數的GBM中存在著不同程度的擴增和突變。GBM中的膠質瘤干細胞被認為是腫瘤發生、耐藥和復發的主要原因。靶向EGFR以及膠質瘤干細胞一直是膠質瘤精準治療中的重要組成部分。
雖然人們據此開發出了大量的分子抑制劑如絡氨酸激酶抑制劑(TKI)等,但其臨床實驗結果令人失望。尚無有效藥物得以應用于臨床。闡釋EGFR的激活機制是GBM精準治療亟待解決的問題之一。
近日,張弩教授團隊通過分析膠質母細胞瘤樣本和配對正常組織樣本的環狀RNA測序(Circ-RNA Seq)以及核糖體印記測序(ribosome profiling),結果發現在傳統意義上的抑癌基因E-cadherin可以形成一個環狀RNA Circ-E-Cad并翻譯小蛋白C-E-Cad。C-E-Cad可以通過自分泌以及旁分泌的方式激活EGFR/EGFRviii并促進膠質瘤干細胞的自我更新。C-E-Cad結合于EGFR/EGFRviii的CR2結構域,引起二者的持續低流量激活(圖1)。
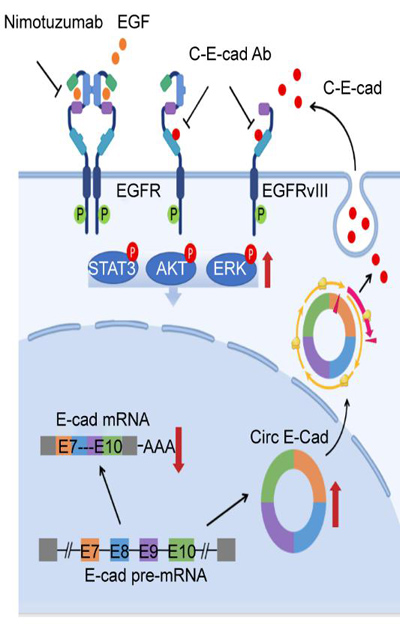
圖1. C-E-Cad促進間質瘤干細胞自我更新模式圖
在裸鼠原位成瘤模型中,張弩教授團隊發現抗C-E-Cad治療可以顯著抑制GBM進程,延長裸鼠生存期,其治療效果優于抗EGFR治療且二者聯用具有較好的協同治療效果。
該研究工作得到了國家重點研發計劃青年科學家項目“環狀RNA翻譯蛋白質的調控過程與生物學功能”、國家自然科學基金優秀青年基金以及面上項目等項目的資助。