
中大新聞網訊(通訊員夏煒)蛋白質的磷酸化是一種由激酶和磷酸酶介導的可逆蛋白質翻譯后修飾(Protein translational modification, PTM)過程。這一動態修飾過程在新陳代謝、轉錄、分化以及細胞間通訊等細胞生命的幾乎所有方面都發揮著重要作用。蛋白激酶在這種調控機制中扮演著核心角色,它們催化ATP的γ-磷酸向蛋白質底物的氨基酸側鏈轉移,從而實現關鍵的磷酸化過程。在眾多蛋白激酶當中,McsB是革蘭氏陽性菌中目前已知的唯一一種精氨酸磷酸化激酶。其主要參與了細菌蛋白質功能和穩定性的動態調控。在熱應激條件下,McsB與激活蛋白McsA結合后能夠有效磷酸化熱休克轉錄調節因子CtsR,CtsR的磷酸化修飾是解除其對clpC啟動子轉錄抑制的關鍵步驟,這一修飾激活了蛋白質質量控制系統核心組件的轉錄和表達,從而降解細菌中因熱應激產生的變性蛋白質。在這一過程中,金屬蛋白McsA能夠結合McsB,增強其激酶活性,這一事實已經被廣泛報道,但有關McsA-McsB復合物的結構基礎以及McsA如何激活McsB使底物CtsR發生磷酸化動態修飾的分子機制仍然未知。解析McsA激活McsB的分子機制,有助于深入研究細菌在熱壓力下如何利用磷酸化動態修飾維持蛋白質穩態,并基于此開發針對性的干預藥物,將為抗菌治療提供新的思路和理論依據。
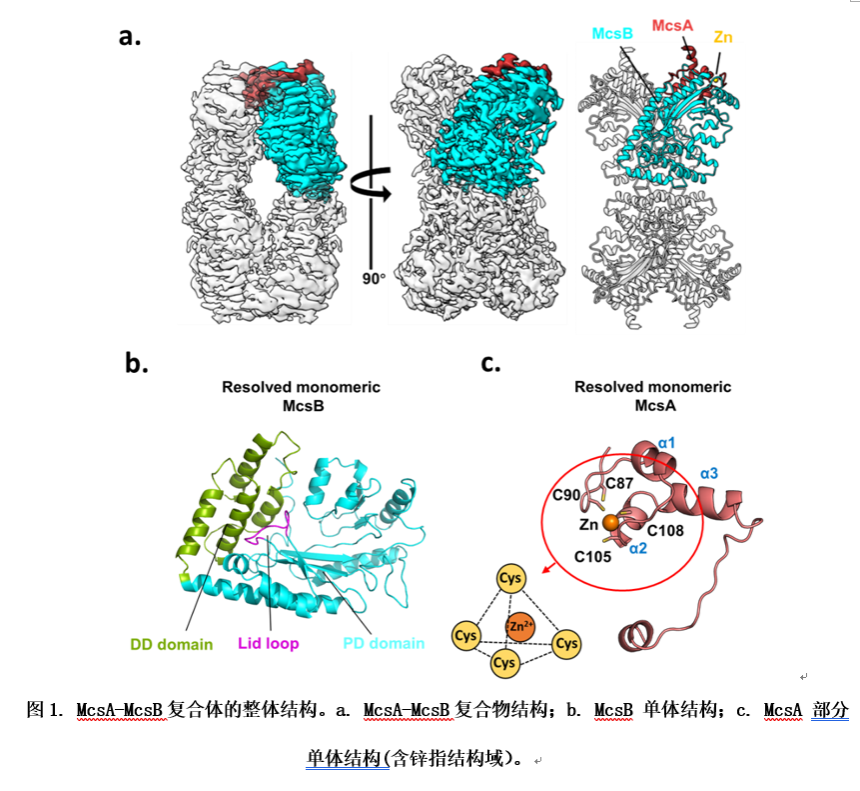
近日,中山大學的毛宗萬教授、夏煒教授和四川大學華西醫院的蘇昭銘教授合作,首次報道了金黃色葡萄球菌的McsA-McsB復合物的冷凍電鏡結構。結果顯示McsB的四個亞基占據中心位置,形成一個夾層二聚體。兩個二聚體之間有 30°的旋轉角,暴露出激酶的活性位點。每個McsA亞基位于復合物的四個遠端分別利用一個鋅指結構域及兩個α螺旋與一個McsB單體相互作用,從而形成4 McsA-4 McsB的復合物形式。若破壞該鋅指結構域,則McsA無法結合McsB,進而無法激活McsB。揭示了鋅離子在維持McsA正常結構及其與McsB相互作用中的重要作用。
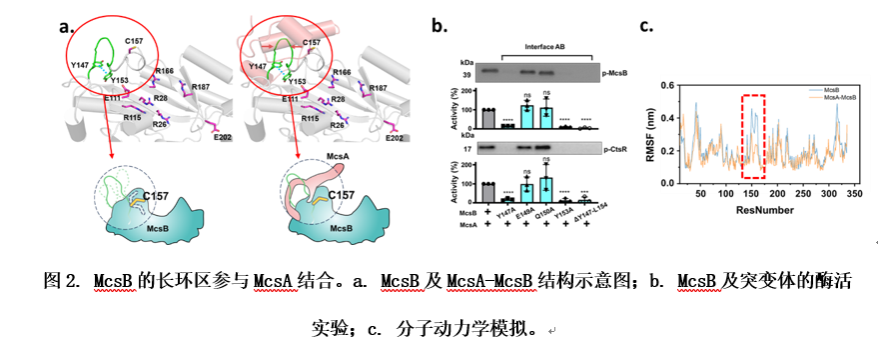
觀察McsB與McsA的相互作用面可知,McsB通過一段長環區與McsA的鋅指結構域和兩個α螺旋完成相互作用。在單獨的McsB中,McsB長環區主要通過兩個酪氨酸殘基Y147和Y153形成典型的T型π-π堆積,以保持穩定。值得注意的是,催化殘基之一的C157位于同一環區。若破壞該π-π堆積,則會擾亂催化殘基C157的朝向,最終導致McsB完全喪失激酶活性。由于McsB長環區的構象對其激酶活性的關鍵作用,研究者推測McsA結合可能會穩定該環區,從而固定催化殘基C157的朝向,進而加強McsB對CtsR的磷酸化修飾活性。為了驗證假設,研究者對McsB和McsA-McsB復合物結構進行了分子動力學(Molecular Dynamics,MD)模擬。RMSF分析表明,與McsA-McsB復合物結構相比,McsB的一個區域(殘基I145-G164)的柔性大大增強。這一柔性區域包括McsB長環區域(殘基Y147-L154)和關鍵的催化殘基(Cys157)。這些發現揭示了McsA在穩定和限制McsB長環區和保守催化Cys殘基的動態行為中的關鍵作用。
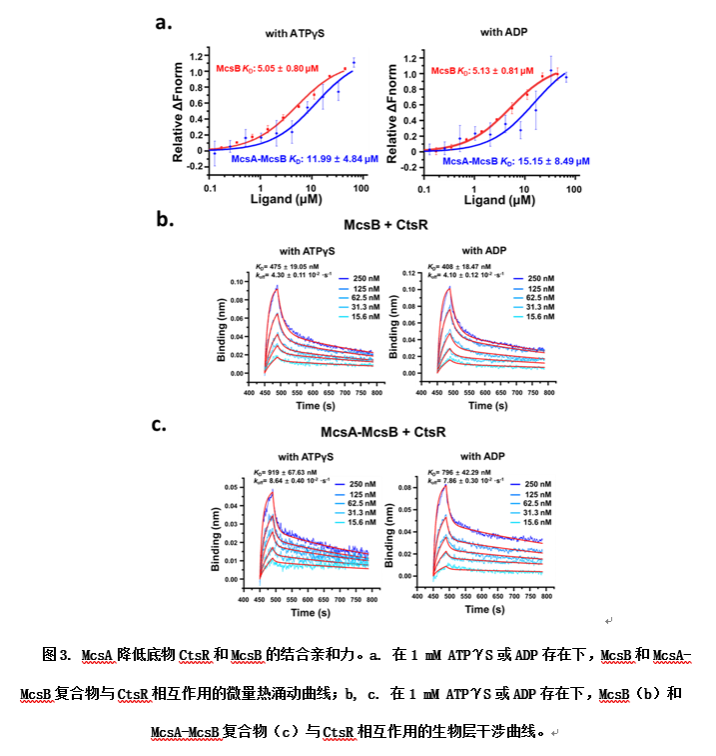
此外,結構信息顯示McsA的結合位點接近McsB的底物結合口袋,表明McsA可能會干擾McsB和底物CtsR之間的相互作用。研究者通過微量熱涌動(Microscale Thermophoresis,MST)和生物層干涉(Bio-Layer Interferometry,BLI)等實驗表明,McsA的結合會降低McsB對CtsR的結合親和力。重要的是,這種親和力的降低主要體現在解離速率的增加,表明了McsA的結合加速了磷酸化CtsR的離去速率從而加快了反應循環。
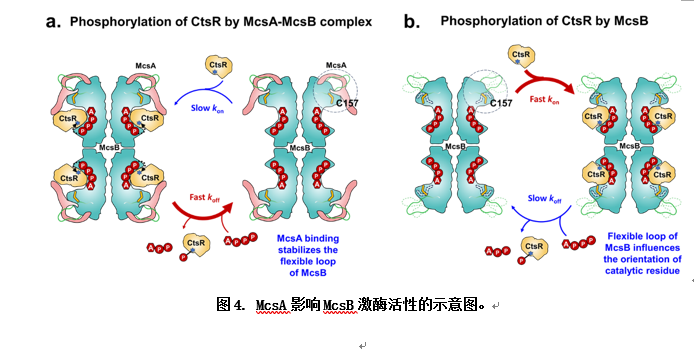
此項工作首次解析了激酶復合物McsA-McsB的冷凍電鏡結構,揭示了McsA通過鋅指結構域及α螺旋與McsB結合,穩定了McsB的關鍵催化半胱氨酸殘基C157并顯著降低了底物蛋白CtsR與McsB的結合能力,加速磷酸化CtsR的離去速率,從而增強McsB的精氨酸激酶活性,實現對CtsR的磷酸化修飾。這種磷酸化修飾通過McsA激活McsB后對CtsR的精準調控,使得CtsR的抑制作用得以解除,從而迅速響應環境變化,有效維持了細胞內蛋白質的質量和功能穩定。
相關研究成果于9月4日發表在Nature Chemical Biology期刊上。化學院博士研究生盧開和陶璇以及四川大學華西醫院研究助理羅炳男為該論文的共同第一作者,四川大學華西醫院的蘇昭銘教授、中山大學化學學院的夏煒教授和毛宗萬教授為該論文的通訊作者。該研究工作受到了國家自然科學基金、國家重點研發計劃項目、中央高校基本科研業務費專項資金和四川大學啟動資金等項目的支持。