
創傷性脊髓損傷可導致脊髓神經元的大量死亡,嚴重的會使患者完全喪失運動和感覺功能,造成受損節段以下完全癱瘓。神經干細胞移植一直被認為是一種可行的脊髓損傷細胞療法,可有效補充受損死亡的神經元并重建神經網絡。然而,由于移植干細胞極低的存活率和體內分化方向不受控制等突出問題,直接將未成熟的神經干細胞注射到損傷部位后,脊髓神經再生和功能恢復效果并不理想。
針對脊髓損傷細胞移植療法中的痛點問題,材料科學與工程學院白瑩副教授團隊提出了一種利用天然脊髓組織來源的脫細胞基質微凝膠作為神經干/祖細胞(Neural stem/progenitor cells, NSPCs)移植載體,通過體外預分化和微創原位注射方式對嚴重的脊髓挫傷疾病模型進行細胞治療。由于該脫細胞基質微凝膠具有脊髓組織特異性的生物活性,可在體外促進NSPCs向神經元分化,并在移植后通過改善脊髓損傷微環境募集內源性干細胞,實現細胞移植療法與內源性修復再生的協同作用。這種原位細胞治療方法成功提高了移植NSPCs用于脊髓損傷治療的術后效果,具有極強的臨床轉化潛力。
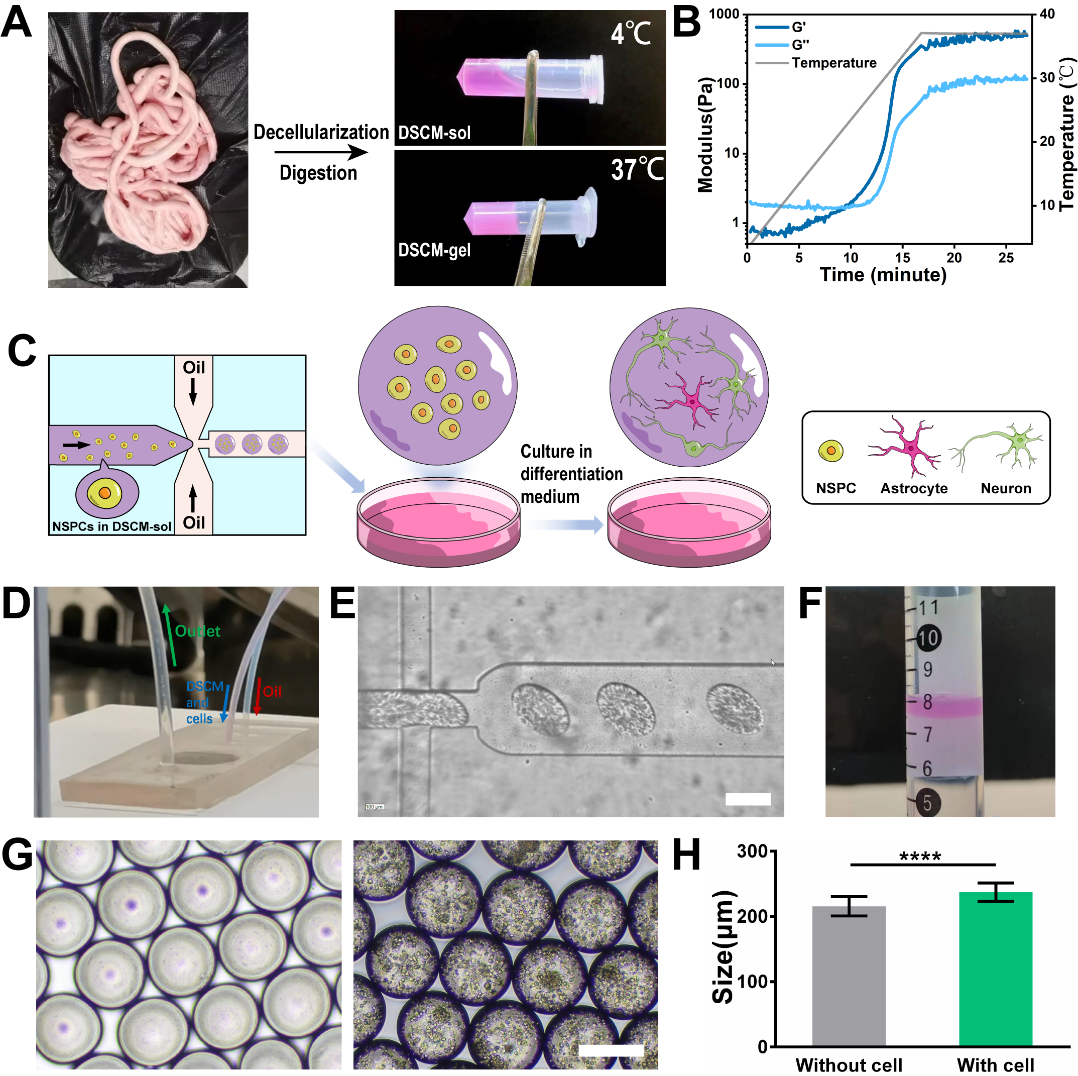
圖1. NSPC@DSCM-MGs的制備過程
首先,本研究使用自主搭建的微流控系統將NSPCs封裝在脊髓來源脫細胞基質微凝膠(DSCM-MGs)中,成功獲得了負載NSPCs的脫細胞基質微凝膠(NSPC@DSCM-MGs),并在體外對其進行神經元向分化誘導。結果證明, NSPC@DSCM-MGs 中三維孵育的NSPCs在七天內大部分向神經元而非星形膠質細胞分化。該結果同時表明基于微凝膠的三維培養體系,相比于傳統的大塊水凝膠三維培養,可以更加明顯地提高NSPCs向神經元分化的效率。

圖2. NSPC@DSCM-MGs在體外預孵育可促進NSPCs向神經元分化
將經誘導分化預孵育NSPC@DSCM-MGs產生的3D神經球注射到嚴重挫傷的大鼠脊髓模型中,發現脫細胞基質微凝膠可有效保護移植細胞,免受剪切損傷和病變部位炎癥微環境的損傷,顯著提高了外源性細胞的存活率。此外,NSPC@DSCM-MGs在體內提高了移植的以及募集的內源性NSPCs向神經元分化的效率,有效補充了脊髓損傷后損失的神經元數量,抑制了膠質瘢痕的形成。此外,大量存活的預分化NSPC@DSCM-MGs積極調節損傷部位微環境,促進內源性細胞募集、軸突再生和神經網絡重建,并幫助維持脊髓組織結構的完整性,促進了嚴重脊髓挫傷大鼠的運動功能恢復。

圖3. 移植的NSPC@DSCM-MGs在體內促進軸突再生和神經網絡重建
綜上所述,這種基于脫細胞基質微凝膠載體及預孵育技術的新型干細胞移植策略,在細胞保護和細胞命運調控方面顯示出獨特的優勢,通過內源性和外源性細胞的協同作用有效促進受損脊髓的再生修復。該方法在組織工程和再生醫學領域的臨床應用中具有極大前景,并且有希望擴展應用于其他疾病的治療中。
該工作于2024年6月20日以“Transplantation of Pre-Differentiated 3D Neural Spheroids in Decellularized Extracellular Matrix Microgels Promotes Neuronal Network Reconstruction and Functional Recovery after Severe Spinal Cord Contusion”為題在線發表于國際知名學術期刊Advanced Functional Materials上(DOI:10.1002/adfm.202407097)。材料科學與工程學院21級碩士研究生張可鑫(排名第一)和博士后饒子龍為該論文共同第一作者,白瑩副教授為唯一通訊作者,材料科學與工程學院為論文第一單位。該研究工作受到國家自然科學基金、廣東省基礎與應用基礎研究基金等項目的大力支持。