
通訊員(蔡楠、樊雨晴、馮賢哲)7月3日,中山大學附屬第七醫院何裕隆、張常華教授團隊在《自然》(Nature)雜志發表最新研究成果,解開腫瘤糖代謝和耐藥機制百年謎題。該研究首次揭示了一種DNA修復蛋白NBS1乳酸化修飾在腫瘤化療耐藥中的關鍵調控作用,并創新性提出通過靶向抑制NBS1蛋白的乳酸化修飾或調控乳酸代謝通路,可以有效逆轉化療耐藥。
“研究不僅揭示了腫瘤細胞如何通過糖代謝抵抗化療,還篩選出一種能有效阻斷腫瘤細胞產生耐藥性的靶向藥物。這項重大發現將對腫瘤診斷與治療產生深遠影響,為腫瘤化療耐藥研究打開新篇章。研究還為腫瘤免疫治療、腫瘤復發與轉移等問題研究開辟了新視角,有望突破腫瘤化療耐藥治療的瓶頸。”論文通訊作者、中山大學附屬第七醫院副院長張常華說。
腫瘤放化療是目前癌癥臨床治療的一種常規手段,腫瘤患者在接受放化療、靶向藥物治療初期通常能取得很好的療效。但伴隨著療程增加,腫瘤細胞會逐漸產生耐藥性,治療效果大打折扣。據張常華介紹,這是因為腫瘤細胞非常狡猾,它們在受到化療藥物攻擊時,會緊急啟動“自我保護”機制,迅速升級防御系統,繼續生長和擴散。
腫瘤細胞為何會具有如此強的自我修復和應變能力?腫瘤細胞的耐藥機制何以破解?
100多年前就有科學家指出,腫瘤細胞與正常細胞不同,無論在有氧還是無氧環境下,它們都會都通過糖酵解途徑代謝,并產生大量乳酸。但百年來醫學界一直無法解釋清楚,腫瘤細胞為何會通過這種高消耗低產能的方式進行代謝,有何功能作用?
2019年,一篇發表在《自然》雜志上的論文吸引了團隊成員陳恒星博士的注意,該研究稱,乳酸可以作為酰化修飾的供體,調控底物蛋白功能。一直以來,乳酸被視為一種“代謝廢物”,并未引起過多關注。而這篇論文恰好指出乳酸并非毫無用處。這啟發陳恒星思考,“腫瘤細胞產生大量乳酸,到底是用來干什么?”
在此背景下,何裕隆、張常華教授團隊圍繞三大關鍵科學問題開展研究:乳酸是否以乳酸化修飾的形式參與腫瘤進展過程?是否會在腫瘤化療耐藥過程中發揮重要作用,其具體機制是什么?能否通過干預乳酸化修飾逆轉化療耐藥?
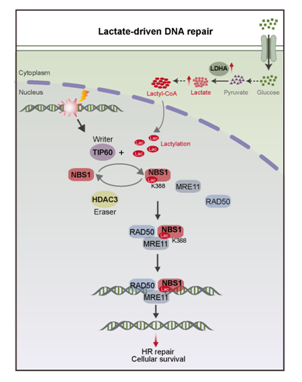
機制示意圖
原來,腫瘤細胞在利用乳酸進行“自救”。歷時四年,研究團隊通過蛋白質組、代謝組和乳酸化修飾組學等多組學技術開展實驗論證。通過分析新輔助化療敏感或耐藥的胃癌腫瘤組織標本,發現在耐藥腫瘤組織中,糖酵解通路顯著上調,乳酸水平顯著上升。研究結果顯示,乳酸在腫瘤細胞中可通過促進乳酸化過程,增強腫瘤細胞DNA的損傷修復能力。當腫瘤細胞受到放化療的損傷時,它們可以快速修復受損的DNA,從而降低放化療的效果,導致耐藥發生。這解答了腫瘤細胞有氧糖酵解功能作用這一困擾全球醫學界的百年謎題。
此外,團隊首次發現了一種能夠阻斷DNA損傷修復的靶向藥物,即司替戊醇。該藥物能夠抑制乳酸的產生和乳酸化過程,從而破壞腫瘤細胞的DNA修復機制,使它們重新對放化療敏感。司替戊醇是治療兒童癲癇的常見藥,可以說是“老藥新用”,其臨床應用的安全性已經明確,研究人員可以直接從劑量、適應證和有效性進行臨床試驗。這一發現為臨床治療帶來了新的希望,有望轉化為有效的抗癌療法。
目前,團隊已啟動相關臨床研究,開始招募患者進行前瞻性臨床試驗。若試驗成功,將為癌癥治療帶來革命性變化,極大提高放化療成功率,造福廣大腫瘤耐藥患者。
這一突破性研究成果得益于中山大學附屬第七醫院團隊對腫瘤耐藥機制問題的長期關注,是一次從臨床研究中發現問題、最終回到臨床應用中造福患者的實踐。“用于本次研究前后對比實驗的腫瘤組織樣本十分珍貴”,陳恒星回憶研究過程時感慨,“何裕隆院長很早就提出規劃,要建立胃腸道腫瘤的生物樣本庫。
何裕隆教授、張常華教授手術工作照
作為一家研究型教學醫院,該院高度重視基礎研究和臨床應用的深度融合,致力打造源于臨床、服務臨床的科研體系。依托中山七院科研中心和深圳市消化系統疾病臨床醫學研究中心等聯合研究平臺,中山大學附屬第七醫院將扎實推進“研究-應用-轉化-推廣”的臨床醫學之路,建設獨具中大特色和深圳樣板的高水平研究型醫院。