
中大新聞網訊(通訊員鄧冠軍)2023年12月,中山大學藥學院(深圳)的鄧文斌教授團隊在Advanced Functional Materials發表了題為“Engineered Microglia-Exosomes Coated Highly Twisting AIE Photothermal Agents to Efficiently Cross Blood-Brain-Barrier for Mild Photothermal-Immune Checkpoint Blockade Therapy in Glioblastoma”的文章。近年來,免疫檢查點阻斷療法刷新了免疫治療的效果,特別是對于肺癌、黑色素瘤等癌癥的治療,將五年生存率整體提高了三倍左右。然而,在膠質母細胞瘤的治療中,免疫檢查點阻斷療法的效果卻非常有限。經各種研究分析發現,這一困境主要有三個原因:一是抗體等大分子藥物難以穿透血腦屏障、靶向膠質母細胞瘤;二是腫瘤微環境中缺乏足夠數量的預先存在的CD8+T細胞;三是化療藥物常常導致耐受性產生。
研究團隊開發了一種外泌體藥物遞送平臺,該平臺能夠跨越血腦屏障并特異性地靶向膠質母細胞瘤,研究團隊通過基因工程的方法將免疫檢查點抗體anti-LAG3表達在小膠質細胞外泌體上而制備了工程化小膠質細胞外泌體,同時將光敏劑載入表達anti-LAG3的工程化外泌體中而形成EE@Fs-NPs。由于工程化小膠質細胞外泌體膜上表達整合素蛋白VLA-4和LFA-1能夠打開血腦屏障形成“綠色通道”,從而使EE@Fs-NPs順利進入腦部。此外,工程化小膠質細胞外泌體使EE@Fs-NPs特異性靶向膠質母細胞瘤,因此,EE@Fs-NPs成功將免疫檢查點阻斷抗體和光熱劑遞送到腫瘤部位。免疫檢查點阻斷抗體anti-LAG3逆轉T細胞耗竭狀態,聯合在激光照射下EE@Fs-NPs能產生溫和光熱治療,提高膠質母細胞瘤對免疫檢查點阻斷療法的響應度以及不會產生耐藥性,實驗表明溫和光熱-免疫聯合治療顯著性提高膠質母細胞瘤的治療效果。
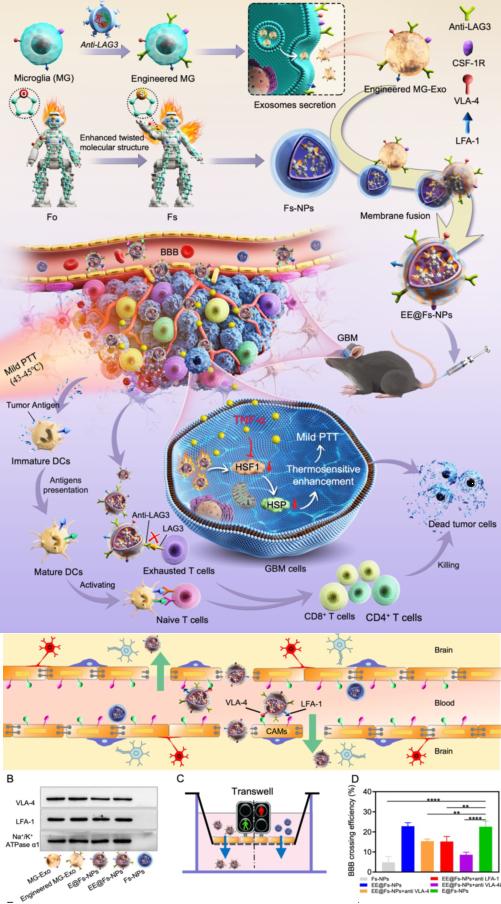
研究示意圖
該研究揭示了工程化小膠質細胞外泌體作為腦部藥物遞送載體的獨特優勢,這種細胞外泌體能夠跨越血腦屏障并具有高度的靶向性,使其成為一種非常有前景的工程化遞送系統,基于工程化小膠質細胞外泌體的藥物遞送載體有潛力成為中樞神經系統疾病治療的通用平臺,為小分子藥物以及大分子抗體的輸送提供可行的解決方案。另外,EE@Fs-NPs介導的光熱-免疫協同治療平臺可以有效應對化療藥物耐受性等問題,為存在耐藥菌感染的患者提供創新的治療模式。這一研究成果不僅為膠質母細胞瘤患者帶來了希望,同時也有望在其他中樞神經系統疾病的治療中發揮重要作用,如腦卒中、阿爾茨海默病等。研究團隊對于該平臺的未來臨床應用前景充滿信心,并期待這一研究成果能夠為醫學領域帶來新的進展。
該論文的第一作者為中山大學藥學院(深圳)博士研究生林珣,通訊作者為中山大學藥學院(深圳)鄧文斌教授和鄧冠軍副教授,中國科學院深圳先進技術研究院蔡林濤研究員。該研究得到了國家自然科學基金,廣東省自然科學基金等項目支持。
論文鏈接:https://doi.org/10.1002/adfm.202310237