
酶是一類具有生物催化功能的生物大分子,其效率、特異性和選擇性遠遠超過人工催化劑。基于酶的生物催化在可持續合成、藥物設計、生物工程以及傳感等研究中異常活躍,并得到迅速發展。然而,酶固有的脆弱性質,如活性容易受溫度、pH、有機溶劑及小分子抑制劑等影響,使酶體系在實際操作中具有穩定性差和使用壽命短等問題。金屬有機框架(Metal-Organic Frameworks, MOFs)是一種是由有機配體和金屬離子或團簇通過配位鍵自組裝形成的具有分子內孔隙的有機-無機雜化材料。MOFs具有比表面積高、孔徑可調、組分多樣、表面易功能化等諸多優點。將酶原位封裝于MOFs空腔(酶@MOFs)就如給脆弱的酶穿上堅實的“MOFs盔甲”,已被證實可有效提高酶的穩定性和使用壽命;同時,MOFs保護層的多孔網絡結構也可選擇性使底物擴散進入酶的活性位點。這種共生強化效應賦予酶@MOFs在傳感、催化和生物工程等領域巨大的應用潛力。但是,目前這些初步的研究主要集中于將酶包埋于具有保護作用的MOFs空腔,但對酶封裝前后的活性轉化及影響因素仍缺乏系統研究。
近日,我校化學學院歐陽鋼鋒教授團隊揭示封裝模式是如何影響酶@MOFs的生物功能,并提供一種新的策略可制備具有高生物活性的酶@MOFs材料。研究人員以6種工業用途廣泛的酶為模型(括葡萄糖氧化酶(GOx)、細胞色素C (Cyt C)、辣根過氧化物酶(HRP)、過氧化氫酶(CAT)、尿酸氧化酶(UOx)和乙醇脫氫酶(ADH)),研究了它們原位封裝于ZIF-8空腔后的活性轉化。研究結果發現部分酶可保持較高的生物活性,但另一部分酶活性則嚴重下降甚至完全失活。接著,研究人員通用過系統的表征手段發現酶的活性轉化與其封裝模式密切相關:1)在基于酶誘導ZIF-8成核驅動的快速封裝模式中,得到的酶@ZIF-8保持較高的生物活性;2)在ZIF-8自然成核的共沉淀緩慢封裝模式中(此過程中酶不參與ZIF-8成核),由于過量配體(2-甲基咪唑)的去折疊效應和競爭配位,得到的酶@ZIF-8趨向于失活(圖1A)。有趣的是,這兩種封裝模式與酶的表面電荷性質有關。研究人員通過酶表面氨基酸殘基的化學修飾調節酶的表面電荷,可實現酶@ZIF-8封裝方式的有效調控,進而改善酶@MOFs的生物活性。接著,研究人員探討了改善后的酶@MOFs(Cyt C-A@ZIF-8和HRP-A@ZIF-8)在生物傳感領域的應用。我們首先可以利用Cyt C-A@ZIF-8和HRP-A@ZIF-8對H2O2進行可視化傳感。谷胱甘肽(GSH)是一種生物硫醇,與糖尿病、肝病、白內障、阿爾茨海默病和帕金森病等多種病癥相關。H2O2可氧化GSH進而影響酶@MOFs的H2O2傳感性能(圖1B)。鑒于這一原理,我們建立了一種GSH的可視化酶@MOFs傳感平臺,并具有較高的檢測靈敏度和較寬的線性范圍(圖1C)。與單酶催化相比,多酶催化級聯反應是生物體內一類重要的化學轉化過程,在生物信號轉導和代謝途徑中起著關鍵作用。研究人員將多種酶(GOx和HRP)共封裝于MOFs(簡稱ECMN,圖1D),模擬細胞內級聯催化過程;同時,可以通過調控酶的封裝模式,提高ECMN的級聯催化性能(圖1E),并實現葡萄糖的高靈敏、可視化檢測(圖1F)。
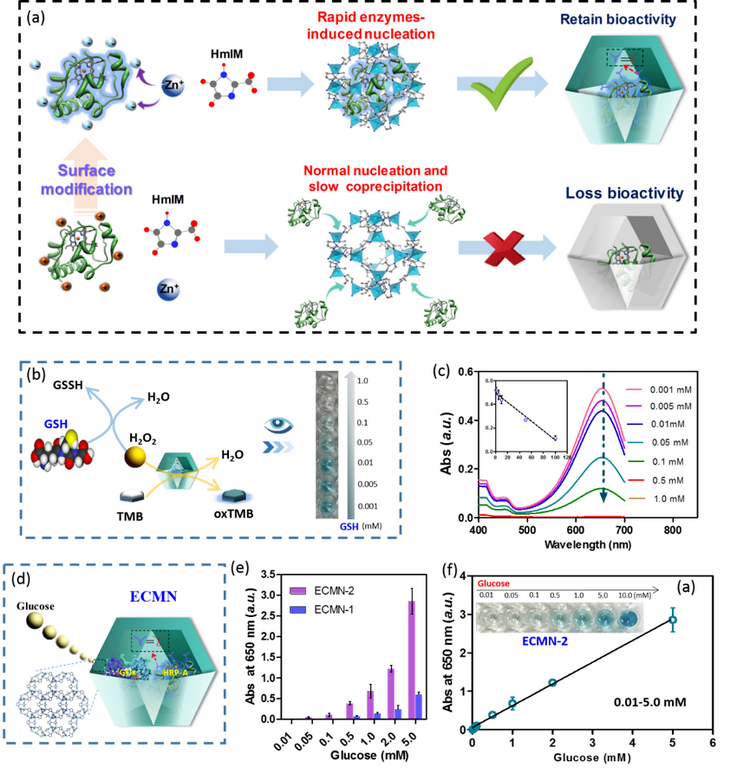
圖1.(A)基于酶誘導ZIF-8成核驅動的快速封裝模式和ZIF-8自然成核的共沉淀緩慢封裝模式的示意圖;
(B)基于HRP-A@ZIF-8的GSH可視化檢測平臺示意圖;(C)紫外吸收強度(650 nm)與谷胱甘肽濃度的
關系圖;(D)GOx和HRP共封裝的ZIF-8 ECMN的示意圖;(E)ECMN的級聯催化性能的提升;
(F)葡萄糖的高靈敏、可視化檢測
該研究成果發表在化學綜合期刊Angewandte Chemie International Edition,文章的第一作者是中山大學博士后陳國勝,通信作者為歐陽鋼鋒教授。
此外,研究團隊從封裝策略及應用兩方面總結了酶@MOFs的最新研究進展:重點介紹了MOFs孔徑結構和酶生物界面與金屬離子的相互作用對酶封裝效率的影響及影響酶活性轉化的關鍵因素;并展示了酶@MOFs在生物傳感、催化和納米催化治療等領域的前沿應用。相關成果以題為“Armoring the Enzymes with Metal-Organic Framework”發表在化學綜合期刊Angewandte Chemie International Edition,文章的第一作者是中山大學孫逸仙紀念醫院博士后黃思銘,通訊作者為陳國勝博士后和歐陽鋼鋒教授。
以上研究工作得到了國家自然科學基金(21904146,21737006,21677182,21527813和21477166)、博士后創新人才支持計劃(BX20190390)、博士后基金面上項目(2019M653138)、廣東省自然科學基金面上項目(2019A1515011722)和高校基本業務費(19lgpy125)等項目的資助。
論文鏈接:https://onlinelibrary.wiley.com/doi/full/10.1002/anie.201913231