
正常細(xì)胞代謝所需的能量主要由線粒體氧化磷酸化產(chǎn)生的ATP提供,而腫瘤細(xì)胞即便氧供充足也偏好利用糖酵解供能。腫瘤細(xì)胞的糖酵解代謝為其提供充足的ATP,利于其生長增殖。近年來,針對腫瘤細(xì)胞能量代謝的研究受到廣泛關(guān)注,基于腫瘤能量代謝的內(nèi)在分子機(jī)制研究,將對腫瘤治療提供新的指導(dǎo)方向。N6-甲基腺嘌呤(m6A)mRNA修飾在細(xì)胞的生物學(xué)功能具有多種調(diào)控作用。研究發(fā)現(xiàn)腫瘤細(xì)胞的m6A修飾調(diào)控腫瘤的生長、增殖及轉(zhuǎn)移,然而m6A修飾是否參與腫瘤細(xì)胞的能量代謝中尚待深入研究。
近日,我校藥學(xué)院王紅勝教授課題組在Nature Communications期刊上發(fā)表題為“N6-methyladenosine regulates glycolysis of cancer cells through PDK4” 的研究論文,發(fā)現(xiàn)RNA的m6A修飾對腫瘤細(xì)胞的能量代謝有積極調(diào)節(jié)作用,其可通過丙酮酸脫氫酶激酶4(PDK4)參與腫瘤細(xì)胞的糖酵解和ATP生成。
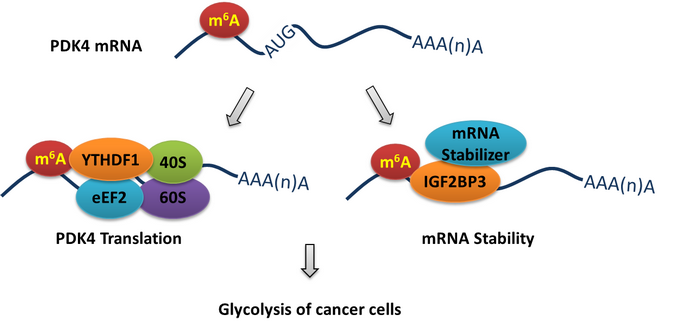
m6A調(diào)控PDK4翻譯及mRNA穩(wěn)定性介導(dǎo)腫瘤細(xì)胞糖酵解示意圖
本研究發(fā)現(xiàn),m6A修飾參與腫瘤細(xì)胞的糖酵解和ATP生成。甲基轉(zhuǎn)移酶METTL3的缺失使得m6A水平下調(diào),并抑制腫瘤細(xì)胞的葡萄糖攝入、乳酸產(chǎn)生速率和ATP生成。m6A-seq和功能實(shí)驗(yàn)表明,PDK4的表達(dá)受m6A調(diào)控,且過表達(dá)PDK4能逆轉(zhuǎn)METTL3缺失導(dǎo)致的腫瘤細(xì)胞糖酵解和ATP生成抑制。進(jìn)一步研究表明,PDK4 mRNA的5’UTR區(qū)而非3’UTR區(qū)的m6A修飾,可通過與YTHDF1/eEF-2復(fù)合物和IGF2BP3結(jié)合,從而正向調(diào)節(jié)其mRNA的翻譯延伸及mRNA穩(wěn)定性。此外,TATA結(jié)合蛋白(TBP)可以通過與METTL3啟動子結(jié)合增強(qiáng)其轉(zhuǎn)錄及在宮頸癌細(xì)胞中的表達(dá)。體內(nèi)和臨床分析表明,m6A/PDK4在宮頸癌和肝癌組織表達(dá)上調(diào),且對其發(fā)生發(fā)展具有促進(jìn)作用。
此外,王紅勝課題組還在Nucleic Acids Research期刊上發(fā)表題為“Targeted mRNA demethylation using an engineered dCas13b-ALKBH5 fusion protein”的研究論文,成功構(gòu)建基于dCas13b-ALKBH5的融合蛋白體系dm6ACRISPR,實(shí)現(xiàn)在活細(xì)胞內(nèi)靶向mRNA進(jìn)行去甲基化修飾。同時,在腫瘤細(xì)胞中運(yùn)用dm6ACRISPR靶向促癌基因EGFR和MYC,可顯著降低其表達(dá)和抑制腫瘤細(xì)胞的生長。
RNA甲基化修飾約占所有RNA修飾的60%以上,而N6-甲基腺嘌呤(N6-methyladenosine, m6A)是高等生物mRNA中最為普遍的轉(zhuǎn)錄后修飾。m6A修飾由“編碼器(Writer)”、“消碼器(Eraser)”和“讀碼器(Reader)”共同調(diào)控其動態(tài)變化。其中,F(xiàn)TO和ALKBH5是目前已知的去甲基化酶,可“擦除”mRNA上的m6A修飾。m6A修飾對細(xì)胞各生物學(xué)行為具有多種調(diào)控作用,然而在活細(xì)胞內(nèi)探討m6A修飾在靶mRNA上的具體作用尚未能實(shí)現(xiàn)。近年來基于CRISPR/Cas體系發(fā)展而來的基因編輯技術(shù)發(fā)展迅速,其中,酶失活型DNA結(jié)合酶dCas9聯(lián)合功能蛋白所構(gòu)建的融合蛋白體系可在活細(xì)胞內(nèi)定向改造DNA的表觀遺傳修飾。與Cas9功能相似,Cas13b可結(jié)合并剪切RNA,而酶失活型Cas13b(dCas13b)聯(lián)合gRNA可在活細(xì)胞內(nèi)結(jié)合靶mRNA,使活細(xì)胞內(nèi)的mRNA表觀遺傳修飾編輯變成可能。
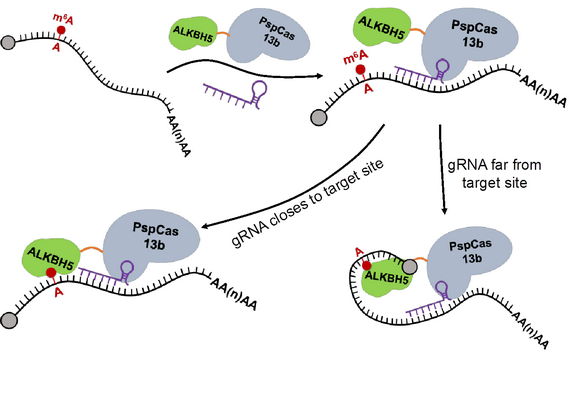
dm6ACRISPR去甲基化編輯示意圖
本研究利用dCas13b融合去甲基化酶ALKBH5,結(jié)合靶向mRNA的gRNA,構(gòu)建出可在活細(xì)胞內(nèi)靶向mRNA的m6A去甲基化修飾體系dm6ACRISPR。該體系具有特異性強(qiáng)、去甲基化效率高和脫靶率低等特點(diǎn)。研究表明,dm6ACRISPR可實(shí)現(xiàn)CYB5A mRNA的單位點(diǎn)及CTNNB1 mRNA的多位點(diǎn)去甲基化,提高靶mRNA穩(wěn)定性。同時,dm6ACRISPR具有高度錯配不耐受的特點(diǎn),其細(xì)胞內(nèi)脫靶率僅為0.03%。此外,在腫瘤細(xì)胞中運(yùn)用dm6ACRISPR體系靶向促癌基因EGFR和MYC,可顯著降低其表達(dá)水平,同時明顯抑制腫瘤細(xì)胞生長,表明dm6ACRISPR在疾病防治上具有潛在價值。
上述研究工作獲得國家自然科學(xué)基金等多項(xiàng)基金的資助,及中山大學(xué)第一附屬醫(yī)院林水賓研究員、德州大學(xué)西南醫(yī)學(xué)中心江正明教授等課題組的幫助。
論文鏈接:https://www.nature.com/articles/s41467-020-16306-5
https://academic.oup.com/nar/article-lookup/doi/10.1093/nar/gkaa269