
在藥物研發過程中,從頭合成藥物分子,成為其進展的限速步驟,并有違綠色化學所提倡的原子經濟性原則。研究表明,通過在先導化合物或候選藥物中引入某些官能團后,不僅可以改變溶解性和代謝穩定性等,還可以改變其與靶標的親和力,顯著提高生物活性。在藥物結構中碳氫鍵幾乎是普遍存在的,開發高選擇性的方法將這些鍵官能團化,能夠快速且高效地合成結構類似的新的化學實體,從而簡化藥物的開發。因此,后期官能團化法在藥物開發中極具研究價值。含氮雜環化合物在藥物中很常見,60%經美國FDA批準的藥物具有氮雜環結構。然而,現有的針對氮雜環的碳氫鍵功能化的方法仍然非常有限。
近日,我校藥學院趙德鵬教授課題組在氮雜環的碳氫鍵功能化的研究中取得了重要進展,報道了一種以Cu作為催化劑的氮雜環α位碳氫鍵官能化反應,可成功應用于多種雜環、多肽以及藥物的官能化。該方法采用市售的催化劑,操作簡單,底物范圍廣泛(包含多種藥物中常見的雜環結構),官能團兼容性高,并且在多個雜環的克級反應實驗中均取得了與小量實驗相近的收率,更加證明了該方法對藥物的合成后修飾具有較強的實用性。
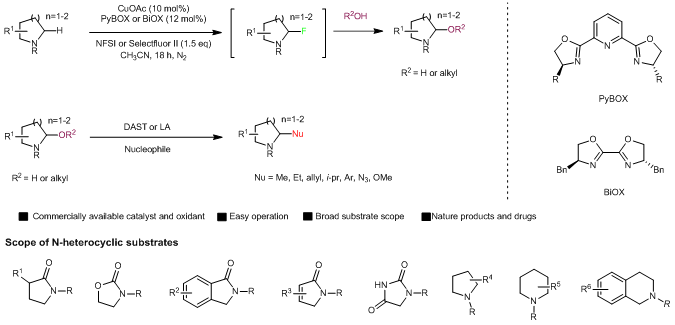
圖1. 氮雜環α位碳氫鍵官能化反應
同時,作者還在氮雜環藥物及多肽修飾方面進行了簡單的嘗試,結果發現不論是藥物(呋喃妥因和吲哚洛芬)、藥物前體(特地唑胺)還是多肽,均可通過該方法實現定點修飾并且得到不錯的收率(41%-97%)。
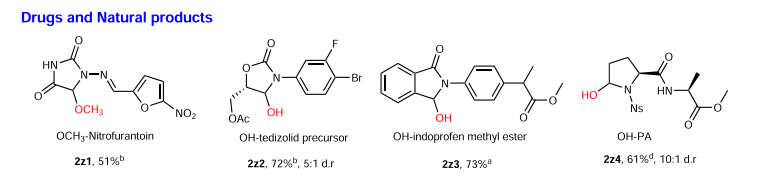
圖2. 藥物及多肽的后期官能化反應
該研究成果近日發表在Nature Communications上,題目為“Copper catalyzed late-stage C(sp3)-H functionalization of nitrogen heterocycles”。論文第一作者為我校藥學院博士研究生常喆,碩士生黃佳林、王思為第二和第三作者,通訊作者為趙德鵬教授和蘭州大學王銳院士。該研究工作得到了國家自然科學基金(21801260和21971267)、廣東省手性分子與藥物發現重點實驗室(2019B030301005)、國家海外高層次引進人才項目、廣東省創新創業團隊引進計劃(2017ZT07C069)等的支持。