
鉑類藥物是廣泛使用的一線化療藥物,用于包括卵巢癌、肺癌、頭頸癌等多種癌癥的治療,素有“癌癥的青霉素”之稱。其中順鉑被列入世衛組織基本藥物標準清單和中國國家基本藥物目錄。但耐藥問題和副作用一直困擾著鉑類藥物的臨床使用。治療初期一些敏感的癌細胞通過所謂的獲得性耐藥(acquired resistance)對順鉑產生抵抗而出現耐藥生長,導致嚴重的腫瘤復發以及患者死亡。由于鉑類藥物在癌癥治療中廣泛使用,系統研究鉑類藥物的獲得性耐藥機制具有直接的臨床轉化價值。
糖皮質激素受體(Glucocorticoid receptor,GR)是細胞內重要的核轉錄因子,調節生長、發育、代謝以及免疫反應等相關基因的表達,對多種生命活動都具有影響。近年來關于GR促進腫瘤的發生、發展以及轉移,也有一些重要的報道。在未激活狀態下,糖皮質激素受體定位于細胞漿內,在與糖皮質激素或者類似激動劑(agonist)結合后暴露出核定位序列,從而被轉運到核內調控下游基因的表達。順鉑等鉑類藥物屬于較高級別的致吐化療藥物,其所引起的惡心和嘔吐(chemotherapy-induced nausea and vomiting, CINV)是腫瘤臨床治療中較為常見副作用,嚴重影響患者的依從性。人工合成糖皮質激素如地塞米松(Dexamethasone)可有效緩解化療藥物帶來的惡心、嘔吐和炎癥性疼痛等副作用而和鉑化療同時使用。但是糖皮質激素受體是鉑耐藥形成中的功能研究仍舊不明。
近日,我校中山醫學院生化教研室潘超云副教授等在Nature Communications在線發表了題為“Cisplatin-mediated activation of glucocorticoid receptor induces platinum resistance via MAST1”的研究論文,專門研究了上述問題。這是繼潘超云教授于2019年6月和2019年10月在Journal of Clinical Investigation發表的關于激酶在鉑耐藥中的功能研究文章后,又一研究成果。中山醫學院為本項研究第一完成單位。
在研究中,潘超云教授等首先建立了獲得性順鉑耐藥的小鼠移植瘤模型,并通過RNAseq分析差異表達基因,轉錄因子陣列篩選、染色質免疫共沉淀等實驗發現獲得性順鉑耐藥形成中,GR驅動了關鍵的順鉑耐藥蛋白MAST1的轉錄。接著作者在細胞系和患者組織中均發現順鉑可以誘導GR的核內轉移,提示順鉑導致GR的激活。
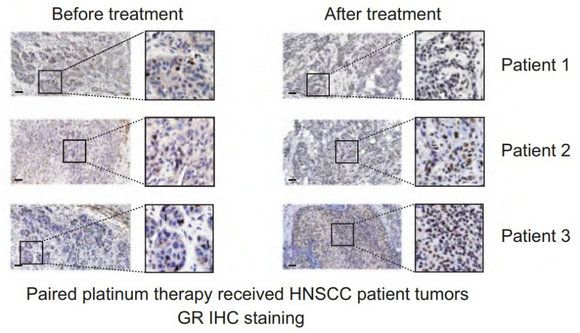
鉑治療前后收集的配對的頭頸癌患者腫瘤組織中GR免疫組化染色。圖中顯示了頭頸癌患者患者腫瘤的代表性GR染色圖像
然后通過熱轉變分析,表面等離子共振等實驗發現順鉑可以直接結合到GR的配體結合結構域(ligand binding domain, LBD) C622位點,而激活GR,并且與糖皮質激素有協同作用。潘超云教授等進一步發現順鉑直接結合C622激活GR誘導MAST1激酶表達是導致癌細胞抵抗順鉑的關鍵因素。最后通過卵巢癌腹腔轉移同源小鼠模型等實驗發現利用MAST1激酶抑制劑可以有效阻斷糖皮質激素誘導的順鉑耐藥。
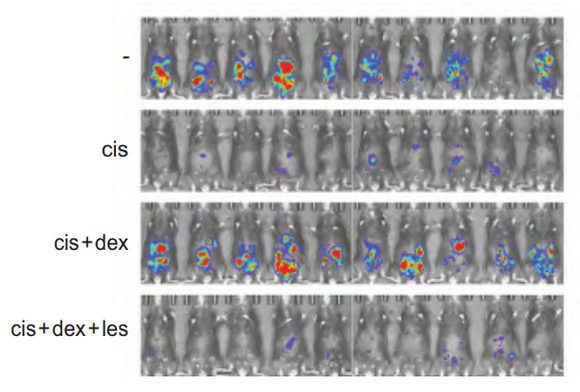
MAST1抑制劑來他替尼對同時接受順鉑和地塞米松治療的 ID8-luc 同源小鼠模型中腫瘤生長的影響
這項研究揭示了糖皮質激素導致獲得性鉑耐藥的機制,并提出靶向MAST1激酶以阻斷GR激活導致的獲得性鉑耐藥的形成。