
中大新聞網訊(通訊員林嬌)生物體內,復雜的基因網絡是細胞發揮功能的基礎。特定環境下,不同基因間相互交流將決定細胞命運。發展操控生物系統分子工具的一個重要目標是能夠人為構建基因回路以調控細胞功能或控制細胞表型。比如,細胞內原本獨立表達的X與Y兩個基因,在引入人為構建的合成回路后,RNA-X能發揮調控RNA-Y表達的作用(圖1)。試想,在癌細胞中,如果X為原癌基因, Y為抑癌基因,在兩者間建立基因回路,以原癌基因誘發抑癌基因表達,將可能實現細胞癌變的源頭防治;而如果X為病毒基因,Y為免疫相關基因,入侵的病毒引起某些免疫相關基因的表達,將可能實現劇烈地激活免疫反應以清除病毒。因此,建立細胞內源基因的關聯調控將可能為細胞引入主動防御機制,以調節其在不同環境下的響應行為,而這也是人工改造細胞的一個重要目的。
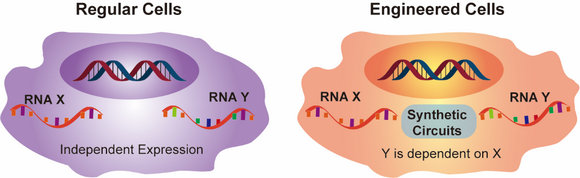
圖1 人為構建內源基因調控回路的概念圖
依據堿基互補配對原則的動態RNA技術為構建基因回路提供了一種通用方法。同時,迅猛發展的CRISPR/Cas9技術為基因表達調控提供了有效工具。中山大學化學學院徐亮教授課題組前期的研究(圖2),通過引入雙發卡中間體調節CRISPR/Cas9功能,進而調控目標基因,在大腸桿菌和哺乳動物細胞中實現了獨立內源基因間的聯系(Nucleic Acids Research, 2020, 48, 11773.)。然而,該策略涉及的組分較多,而且雙發卡的設計較為復雜,急需發展更加簡易高效的分子工具。
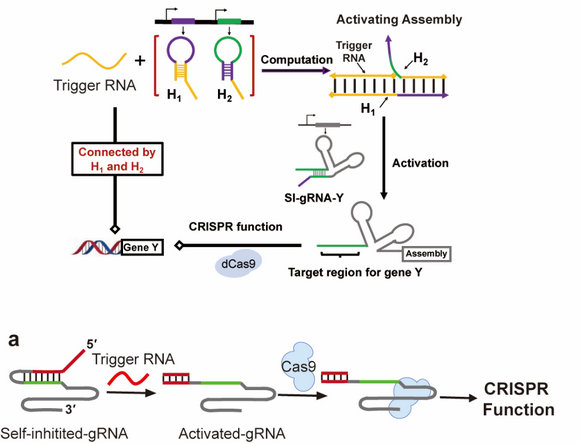
圖2 雙發卡策略:引入雙發卡中間體,在獨立RNA表達之間建立調控鏈接
近日,在之前的研究基礎上,中山大學化學學院徐亮教授課題組報道了一種設計簡單且通用的自組裝策略(圖3),通過工具化的核酸自組裝體系并聯合可激活的CRISPR/Cas9功能實現了內源RNA之間的關聯調控,在大腸桿菌中高效地建立起了完全獨立的內源基因回路,成功地實現了對大腸桿菌的表型控制。此外,初步探索表明此自組裝策略也同樣能夠在哺乳動物細胞中實現。這種RNA自組裝策略為生物體內相互獨立的內源基因之間構建基因回路提供了簡單、通用、高效的方案。該策略在理論上能夠在任意基因表達之間建立起關聯調控作用,從而在細胞內引入新型調控途徑和信號通路。
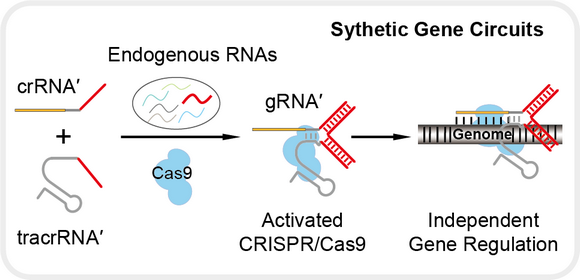
圖3 以RNA自組裝構筑內源基因的關聯調控
這一成果近期以“Building Endogenous Gene Connections through RNA Self-Assembly Controlled CRISPR/Cas9 Function”為題目,發表在Journal of American Chemical Society 上,文章的第一作者是中山大學化學學院2018級博士研究生林嬌,徐亮教授為通訊作者。