
中大新聞網訊(通訊員張海亮)1月13日,國際細胞生物學頂級期刊《自然細胞生物學》(Nature Cell Biology)在線發表了中山大學腫瘤防治中心朱孝峰和鄧蓉團隊的最新成果——“蛋白激酶C-βⅡ亞型通過磷酸化長鏈脂酰輔酶A合成酶4介導脂質過氧化迅速擴增促進鐵死亡”。
中山大學腫瘤防治中心華南腫瘤學國家重點實驗室的朱孝峰教授和鄧蓉教授是本論文通訊作者,中山大學腫瘤防治中心華南腫瘤學國家重點實驗室的張海亮博士是本論文的第一作者。
什么是“鐵死亡”
鐵死亡(Ferroptosis)是鐵依賴的,脂質過氧化驅動的細胞程序性死亡方式。脂質過氧化物的清除受損或過度產生都會導致其積累,達到致死水平而觸發鐵死亡。研究發現,細胞內谷胱甘肽過氧化物酶4(GPX4)、溶質載體家族7成員11(SLC7A11)、鐵死亡抑制蛋白1(FSP1)及GTP環化水解酶1(GCH1)等抗脂質過氧化系統在脂質過氧化物的清除中發揮重要作用。脂質代謝和鐵代謝也參與了鐵死亡的調控,長鏈脂酰輔酶A合成酶4(ACSL4)參與脂肪酸代謝繼而有助于脂質過氧化物生成。含不飽和脂肪酸,特別是花生四烯酸(AA)或腎上腺酸(AdA)的脂質在脂氧合酶Lox,細胞色素P450還原酶POR及二價鐵等的作用下發生過氧化參與鐵死亡調控。
對鐵死亡核心機制的研究將為其在腫瘤治療上的應用打下基礎
鐵死亡與很多病理過程相關,如缺血再灌注損傷、神經退行性疾病、腫瘤等。有研究報道腫瘤的免疫治療及放射治療能通過誘導鐵死亡抑制腫瘤生長。此外,腫瘤細胞通過淋巴道轉移過程中吸收周圍油酸,改變細胞膜質構成逃避鐵死亡,促進轉移。
鑒于鐵死亡在腫瘤惡性進展及治療中的重要作用,對鐵死亡核心機制的闡明將為鐵死亡在臨床上的應用打下堅實基礎。就目前而言,鐵死亡相關的脂質過氧化清除與生成機制已有較多報道,但是,在鐵死亡執行過程中,脂質過氧化的感知分子及其調控鐵死亡作用機制尚不清楚。
中腫團隊研究發現鐵死亡過程中關鍵誘導因素
中山大學腫瘤防治中心朱孝峰和鄧蓉團隊通過成簇規律間隔短回文重復序列及其相關蛋白9(CRISPR-Cas9)及激酶抑制劑庫篩選,發現蛋白激酶C-βⅡ亞型(PKCβII)發揮促進鐵死亡的作用。進一步,作者鑒定了PKCβII是脂質過氧化物的感知分子,PKCβII的激活是鐵死亡執行所必需的。
為闡明PKCβII誘導腫瘤細胞鐵死亡的分子機制,作者利用免疫共沉淀、磷酸化位點預測、體外激酶、特異性磷酸化抗體制備及脂質組學等方法證實,PKCβII磷酸化ACSL4 T328位點,促進ACSL4激活。激活的ACSL4顯著促進含不飽和脂肪酸磷脂的合成,進一步誘導脂質過氧化物的產生。這樣,脂質過氧化-PKCβII- ACSL4正反饋軸的持續運轉,啟動了脂質過氧化的快速擴增過程,最終誘導鐵死亡的發生。
作者在鐵死亡相關的動物模型中進一步證實PKCβII磷酸化ACSL4迅速擴增脂質過氧化的過程在鐵死亡中的作用。發現與ACSL4-WT(野生型ACSL4)相比,ACSL4-T328A(磷酸化失活突變型ACSL4)腫瘤對PD-1抗體敏感性下降。同樣,敲除PKCβII顯著抑制腫瘤對PD-1抗體的敏感性,過表達PKCβII能回復腫瘤的免疫治療療效,且鐵死亡抑制劑顯著抑制PKCβII介導的免疫治療療效增強。這表明PKCβII-ACSL4通過促進鐵死亡增強免疫治療療效,提示PKCβII及ACSL4可作為腫瘤免疫治療療效的分子標記物和靶標。
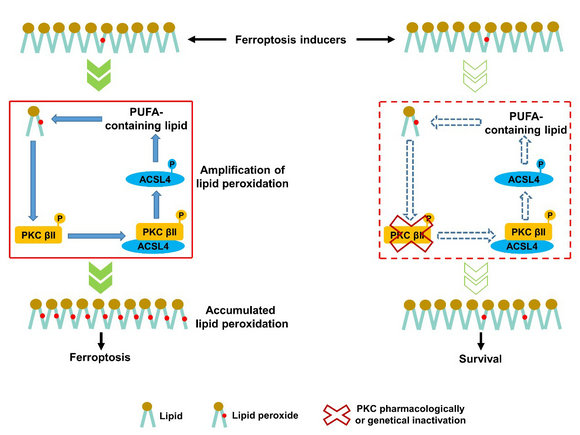
圖:PKCβII-ACSL4正反饋軸啟動脂質過氧化的擴增過程誘導鐵死亡發生
綜上所述,本研究發現了鐵死亡過程中脂質過氧化感知分子PKCβII;揭示了PKCβII介導脂質過氧化迅速擴增促進鐵死亡的分子機制;提示脂質過氧化-PKCβII-ACSL4正反饋通路可為腫瘤等鐵死亡相關的疾病治療提供分子標志物及新靶標。