
中大新聞網訊(通訊員曾雪貞)近日,中山大學附屬第一醫院肝膽胰外科中心學科帶頭人匡銘教授團隊在肝癌消融后復發的機制研究取得重要進展。該研究成果在消化系統疾病國際著名學術期刊Hepatology上發表,文章題目為“Eliminating METTL1-mediated accumulation of PMN-MDSCs prevents HCC recurrence after radiofrequency ablation”。該研究成果為研發預防和治療肝癌消融后復發的藥物提供新的思路。
射頻消融(Radiofrequency ablation, RFA)是廣泛應用于早期肝癌的根治性治療方法,通過引起腫瘤區域局部高熱,直接導致腫瘤細胞發生凝固性變性和壞死,達到良好的治療效果。但是,和其他根治性治療方式一樣,RFA治療后的高復發率是治愈肝癌的一大挑戰。通常,對于體積較大、邊界不規則的腫瘤或存在影像不能檢測到的微轉移灶時,RFA 治療難以覆蓋所有腫瘤細胞達到根治,容易發生不全消融(insufficient RFA, iRFA),導致肝癌復發。有效控制 iRFA 對腫瘤產生的不良影響,是提高RFA 治療效果,減少復發的關鍵。
研究發現,與消融前腫瘤組織相比,消融后復發的腫瘤組織中甲基化轉移酶1(METTL1)的表達顯著升高。同時,腫瘤組織中發揮免疫抑制作用的PMN-MDSC浸潤增多而抗腫瘤免疫的CD8+T細胞浸潤減少。
METTL1是tRNA的m7G修飾酶,通過影響基因的翻譯,調控腫瘤的發生發展過程。在體外細胞模型中,模擬不全消融后進行RNC-seq發現,熱應激后TGF-β通路顯著激活。分析該通路中基因的翻譯倍數變化以及m7G tRNA密碼子頻率后發現,TGF-β2是METTL1的重要下游靶點,并且能夠誘導PMN-MDSC的擴增。
隨后,在小鼠不全消融模型中,研究人員觀察到不全消融后,腫瘤進展加速。通過腫瘤組織單細胞測序、流式細胞術分析發現,與對照組相比,不全消融后METTL1表達顯著升高,PMN-MDSC浸潤增多而CD8+T細胞顯著減少。利用METTL1肝特異性敲除小鼠和METTL1過表達小鼠模型進一步驗證了METTL1在塑造腫瘤免疫抑制微環境的作用。
在小鼠腫瘤細胞中敲除Mettl1或者Tgfβ2,使用Ly6G中和抗體或TGF-β通路抑制劑均能顯著抑制不全消融后殘余肝癌進展,并改善腫瘤免疫抑制微環境。該研究結果為以METTL1-TGF-β2-PMN-MDSC軸為靶點開發藥物減少肝癌消融后復發提供了重要的新思路。
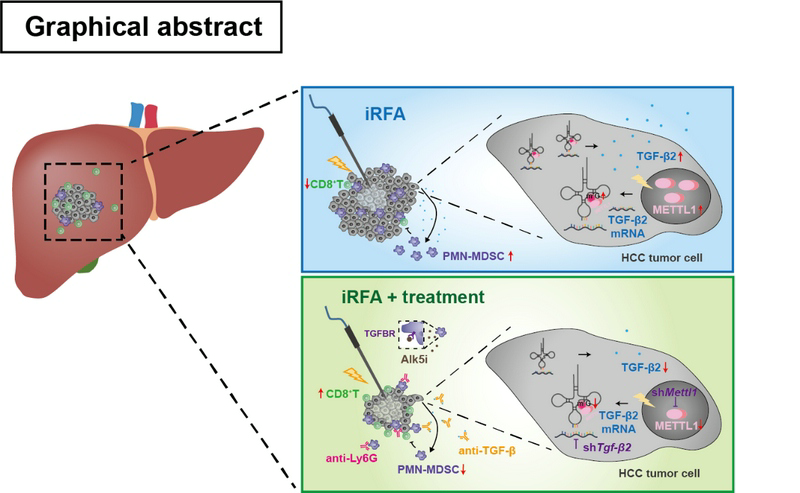
圖片說明:不全消融促進METTL1介導的TGF-β2翻譯,使得腫瘤中PMN-MDSC增多而CD8+T細胞減少。阻斷METTL1- TGF-β2-PMN-MDSC軸,有效抑制不全消融后殘留肝癌進展。
中山大學附屬第一醫院匡銘教授團隊的特聘副研究員曾雪貞是該論文的第一作者,匡銘教授團隊在讀博士生廖冠睿和消化內科在讀碩士生黎淑敏是共同第一作者,匡銘教授是最后通訊作者,精準研究院引進人才王驥教授是共同通訊作者。
論文鏈接:https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.32585