
中大新聞網訊(通訊員張旭東)近日,中山大學醫學院張旭東副教授課題組以“Engineered T cell extracellular vesicles displaying PD-1 boost anti-tumor immunity”為題在國際納米材料領域頂級期刊Nano Today發表了基因工程編輯T細胞來源的細胞外囊泡用于腫瘤免疫治療的研究成果。
近年來,腫瘤免疫治療成為最具臨床應用前景的抗腫瘤手段,尤其是免疫檢查點阻斷療法。程序性細胞死亡蛋白1(Programmed cell death 1,PD-1)是T細胞表面的抑制性免疫檢查點分子,與其配體PD-L1或PD-L2結合后抑制T細胞功能。腫瘤利用這一機制通過表達PD-L1與腫瘤特異性T細胞表面的PD-1結合,導致T細胞活化抑制且功能“耗竭”。為了恢復T細胞抗腫瘤能力,阻斷PD-1/PD-L1通路是腫瘤免疫治療的有效策略。然而,目前靶向PD-1或PD-L1的抗體療法仍存在一定的局限性,如PD-1單抗藥物在臨床治療中的總體響應率不高,且單一免疫療法難以達到理想療效。因此,需要進一步開發針對PD-1/PD-L1檢查點的免疫療法。
細胞外囊泡(Extracellular vesicles, EVs)是由細胞產生分泌的膜囊泡,EVs主要分為微泡(MVs)和外泌體(Exos)。EVs通過運輸脂質,蛋白質和核酸介導體細胞間通訊,具有良好的循環穩定性、天然屏障穿透性和組織細胞靶向性,在癌癥治療和藥物遞送中具有廣闊的應用前景。此外,EVs繼承了其來源母細胞的特性,可發揮多種細胞生理和調節功能。來源于細胞毒性T細胞的EVs含有細胞毒性分子,包括穿孔素、顆粒酶、溶酶體酶和FasL等,具有誘導腫瘤細胞凋亡的潛力。然而,關于T細胞來源的EVs在腫瘤免疫治療中的應用尚未完全被研究和開發。
基于此,張旭東副教授團隊制備了過表達PD-1蛋白的細胞毒性T 細胞EVs,用于阻斷腫瘤細胞與效應T細胞間的PD-1/PD-L1通路,并利用其細胞毒性分子輔助殺傷腫瘤,實現對腫瘤的免疫治療。研究團隊首先通過基因工程改造了T細胞系(CTLL-2),使其過表達PD-1受體蛋白,并通過差速離心獲取其PD-1 EVs。這些EVs表達PD-1、FasL和GzmB等蛋白分子,可在體外與腫瘤細胞通過PD-1/PD-L1的相互作用而結合,并能夠直接誘導腫瘤細胞凋亡(圖1)。在荷瘤小鼠體內,PD-1 EVs可有效抑制腫瘤生長,提高腫瘤微環境中效應T細胞的增殖和活性,增強其抗腫瘤效應,有效延長小鼠生存期。該研究為免疫治療提供了新的可選方法,拓寬了T細胞外囊泡在腫瘤免疫治療中的應用前景。
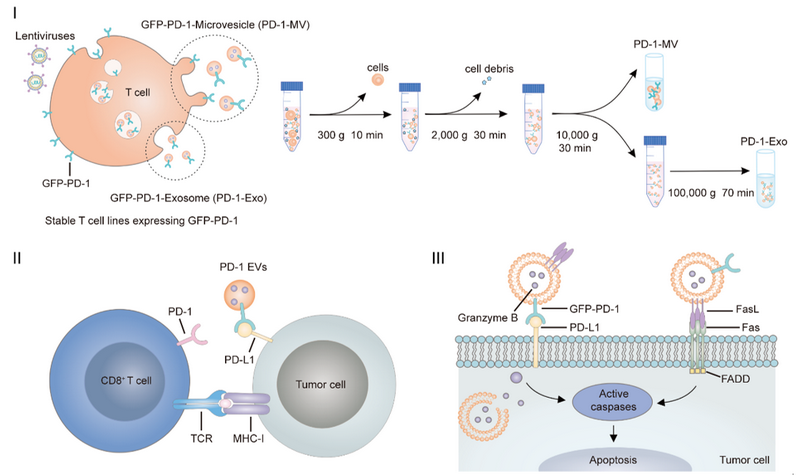
圖1. PD-1-Exo和PD-1-MV的制備和作用機制示意圖
Ⅰ. PD-1-Exo和PD-1-MV的制備;Ⅱ. PD-1 EVs阻斷PD-1/PD-L1通路;TCR:T細胞受體,MHC-I:主要組織相容性復合體I;Ⅲ. PD-1 EVs誘導腫瘤細胞凋亡;FasL:Fas配體,FADD: Fas相關死亡結構域
該論文的第一完成單位為中山大學醫學院。浙江大學藥學院顧臻教授、中山大學醫學院張旭東副教授和廣東醫科大學基礎醫學院梁欣博士為論文的共同通訊作者。共同第一作者為中山大學醫學院研究生李寶琪、房湉靚和李園。這項工作得到了國家自然科學基金,廣東省自然科學基金,深圳市優秀科技創新人才培養項目(優青項目),深圳市基礎研究重點項目的支持。
論文鏈接:https://www.sciencedirect.com/science/article/abs/pii/S1748013222002341