
中大新聞網訊(通訊員趙綺毅)腫瘤干細胞在腫瘤耐藥中起著至關重要的作用。新近發現,腫瘤干細胞的干性(stemness)需要生物機械力環境維持,但生物機械力如何調節腫瘤微環境及其臨床意義尚不清楚。近日,中山大學附屬第三醫院趙綺毅副研究員與中山大學孫逸仙紀念醫院廖建友副研究員、雙聘教授蘇士成團隊合作,在Nature Communications在線發表題為“Niche Stiffness Sustains Cancer Stemness via TAZ and NANOG Phase Separation”的最新研究成果,揭示了生物機械力參與調節腫瘤微環境的新機制,提示腫瘤微環境中的生物機械力是治療腫瘤耐藥的潛在靶點。
既往研究表明,腫瘤微環境中的生化因素(包括細胞因子、膜蛋白和細胞外囊泡中的非編碼RNAs等)能誘導和維持腫瘤干細胞的干性和耐藥性。新近研究發現,腫瘤微環境中除生化因素外,物理因素(如生物機械力)也在組織發育和穩態中發揮關鍵作用,二者共同決定腫瘤干細胞的命運和腫瘤治療反應。然而,微環境生物力學信號維持腫瘤干細胞的干性機制尚不清楚。腫瘤干細胞也存在于腫瘤微環境中,微環境維持了腫瘤干細胞的分化多能性,并保護其免受藥物和免疫反應的影響。
研究團隊利用腫瘤臨床標本和動物移植瘤型,發現腫瘤基質硬度的增加與腫瘤患者對新輔助化療反應差和腫瘤干細胞富集存在關聯;研究還進一步證明了“液-液相分離”機制作為腫瘤干細胞中生物機械力與干細胞轉錄因子轉錄活性之間信號紐帶的作用機制,響應細胞外機械力的機械傳感器與細胞的內生化信號通路耦合,從而調節細胞行為;同時,研究團隊通過機制研究證明了機械轉導分子TAZ被生態位機械力激活后,與干細胞轉錄因子NANOG的N端結構域發生相分離,進而促進干性相關基因SOX2和OCT4的轉錄。
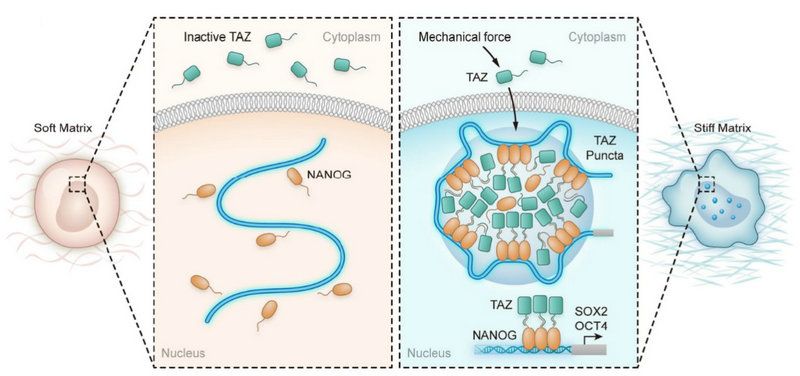
圖1:研究發現腫瘤干細胞生態位硬度增加時,生物機械力轉導分子TAZ被微環境機械力激活進入胞核,進而與干細胞轉錄因子NANOG的N端結構域發生液-相分離,促使NANOG結合到干性相關基因SOX2和OCT4的啟動子區域,促進SOX2和OCT4轉錄,維持腫瘤干細胞相關特性。揭示了生物機械力參與調節腫瘤微環境的新機制,提示腫瘤微環境中的生物機械力是治療腫瘤耐藥的潛在靶點。
論文鏈接:https://www.nature.com/articles/s41467-023-35856-y