
中大新聞網(wǎng)訊(通訊員李咸君、姜鑫)2022年全國癌癥報告顯示,我國肺癌每年新發(fā)病人數(shù)約為82.8萬,死亡病例數(shù)約71萬,位居惡性腫瘤發(fā)病率與死亡率的首位。肺癌進(jìn)展十分迅速,很多人確診時已經(jīng)到了中晚期,而有限的治療手段,使晚期肺癌患者生存率并不理想。作為最具前景的免疫治療方式之一,CAR-T療法(嵌合抗原受體T細(xì)胞療法)在血液腫瘤治療中取得了顯著成功,但因腫瘤中的免疫微環(huán)境對CAR-T細(xì)胞具有明顯的抑制作用,導(dǎo)致該療法在肺癌等實體瘤治療領(lǐng)域的前景尚不明朗。因此,如何提高CAR-T細(xì)胞在實體瘤中療效至關(guān)重要。
近日,中山大學(xué)附屬第五醫(yī)院外科主任兼胸外科主任曹慶東教授團(tuán)隊和學(xué)術(shù)總監(jiān)黃曦教授團(tuán)隊在國際權(quán)威期刊Advanced Materials上發(fā)表題為“Genetically Programmable Vesicles for Enhancing CAR-T Therapy against Solid Tumors”的科研成果。曹慶東教授、黃曦教授為文章共同通訊作者,胸外科在讀博士李咸君為文章第一作者。
該研究開發(fā)了一種能增強(qiáng)CAR-T細(xì)胞治療實體瘤功效的潛在藥物——多功能基因重編程細(xì)胞囊泡(D@aPD-L1 NVs),該藥物通過負(fù)載谷氨酰胺拮抗劑以改善抑制性的腫瘤微環(huán)境達(dá)到增強(qiáng)CAR-T細(xì)胞在肺癌中的治療效果,具有良好的臨床轉(zhuǎn)化潛力和應(yīng)用前景,對進(jìn)一步的臨床應(yīng)用具有重要的指導(dǎo)和借鑒意義,為肺癌領(lǐng)域的治療提供了一種新的策略選擇手段。該成果已申請相關(guān)專利。
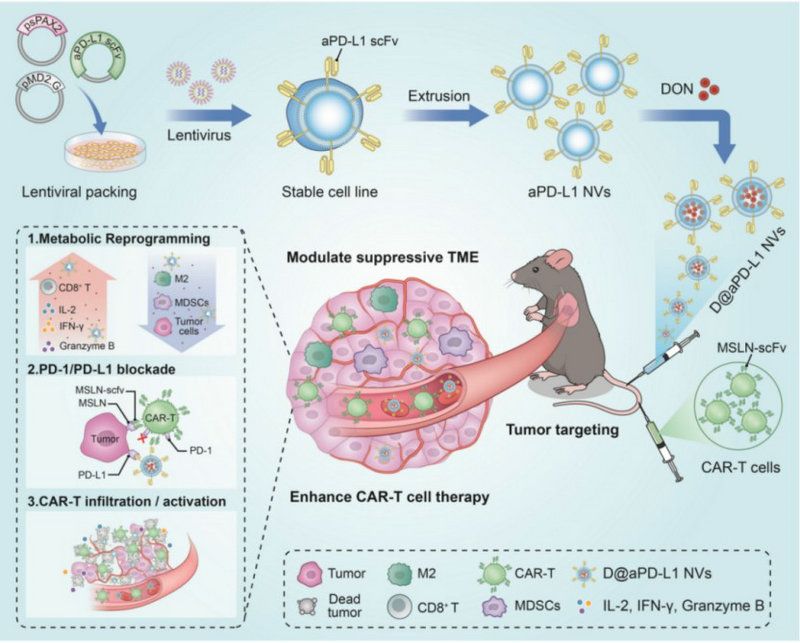
D@aPD-L1 NVs增強(qiáng)CAR-T細(xì)胞在實體瘤中治療效果的示意圖
這種通過基因工程改造的細(xì)胞囊泡表面因表達(dá)有高親和力的PD-L1抗體,能與腫瘤表面的PD-L1抗原發(fā)生特異性結(jié)合,一方面具有良好的腫瘤靶向性,能將藥物靶向遞送到腫瘤部位,避免了谷氨酰胺拮抗劑治療過程中的毒副作用;另一方面,細(xì)胞囊泡表面的PD-L1抗體可有效阻斷PD-1/PD-L1抑制性信號,能有效解決CAR-T細(xì)胞治療過程中引起的腫瘤細(xì)胞表面PD-L1上調(diào),避免了CAR-T細(xì)胞過早發(fā)生耗竭,進(jìn)而起到更好的殺傷腫瘤效果。更重要的是,D@aPD-L1 NVs有效減少了腫瘤微環(huán)境中免疫抑制細(xì)胞的數(shù)量,促進(jìn)了腫瘤組織中炎性細(xì)胞的募集和炎性細(xì)胞因子的分泌。
上述特性使該藥物改善了肺部腫瘤組織中CAR-T細(xì)胞的浸潤和效應(yīng)功能,最終增強(qiáng)了CAR-T細(xì)胞的抗腫瘤及長期記憶免疫能力。研究進(jìn)一步表明,D@aPD-L1 NVs作為一種有前景的藥物,能增強(qiáng)CAR-T細(xì)胞對肺癌的療效,并且細(xì)胞源性囊泡具有良好的生物相容性,在既往的臨床研究中已顯示出其作為藥物遞送系統(tǒng)的安全性和有效性。
論文鏈接:https://pubmed.ncbi.nlm.nih.gov/36814099/