
中大新聞網訊(通訊員陳永明)腫瘤的遠處轉移是導致癌癥患者死亡最主要的原因。目前傳統治療手段如化療等可以減小原位腫瘤大小,但對腫瘤轉移的抑制效果甚微,迫切需要發展新的治療策略來抑制腫瘤轉移以降低腫瘤導致的高死亡率。最近的研究表明,中性粒細胞胞外捕獲網(Neutrophil Extracellular Traps, NETs)中的DNA(NET-DNA)可被腫瘤細胞膜上的DNA感受器CCDC25識別而介導腫瘤細胞從原發部位到遠端器官的轉移。在乳腺癌和結腸癌的病人中,容易發生腫瘤轉移的部位如肝臟和肺部都有大量積聚的NET,這說明NET與腫瘤轉移有著密不可分的關系,NET也因此可望成為抑制癌癥遠端轉移的新靶點。
近日,中山大學陳永明教授和劉利新教授團隊報道了陽離子聚氨基酸納米顆粒(cANP)通過破壞中性粒細胞胞外誘捕網抑制腫瘤轉移的研究發現。該團隊之前采用陽離子聚合物材料清除游離核酸來抑制游離核酸引起的炎癥反應。本項研究采用了生物安全性更好的聚氨基酸作為材料,通過叔胺基修飾提供材料結合DNA的能力。納米顆粒化的陽離子型聚天冬氨酸材料cANP相較于線性聚合物PAsp有更好的肝臟滯留效果,有更高的競爭結合NET-DNA的能力來阻斷NET-DNA與CCDC25的結合,從而更有效地抑制腫瘤細胞向遠端器官的遷移,因此顯示出更卓越的抑制體內腫瘤轉移的效果(圖1)。
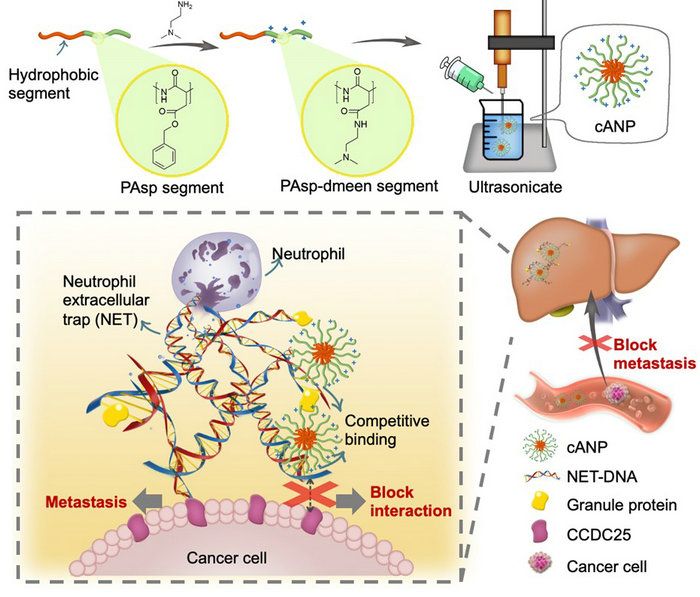
圖1. cANP的制備和通過結合NET-DNA抑制NET誘導的腫瘤轉移的示意圖
該文章采用NCA開環聚合制備聚天冬氨酸化合物,并通過與二乙基乙二胺的胺解反應來調節聚天冬氨酸的胺解程度(10%,50%,100%)。cANP則是由100%胺解后的聚天冬氨酸的嵌段共聚物自組裝而制備(圖1)。由于納米顆粒化的cANP-100%有著比線性聚合物PAsp-100%更高效的DNA結合效率,cANP-100%可以更好地從CCDC25中競爭結合NET-DNA,阻止NET-DNA與CCDC25的結合,并且破壞NET的形成,從而更好地抑制了由NET-DNA誘導的人乳腺癌細胞MDA-MB-231的細胞骨架變形、粘附、遷移和趨化的能力(圖2)。
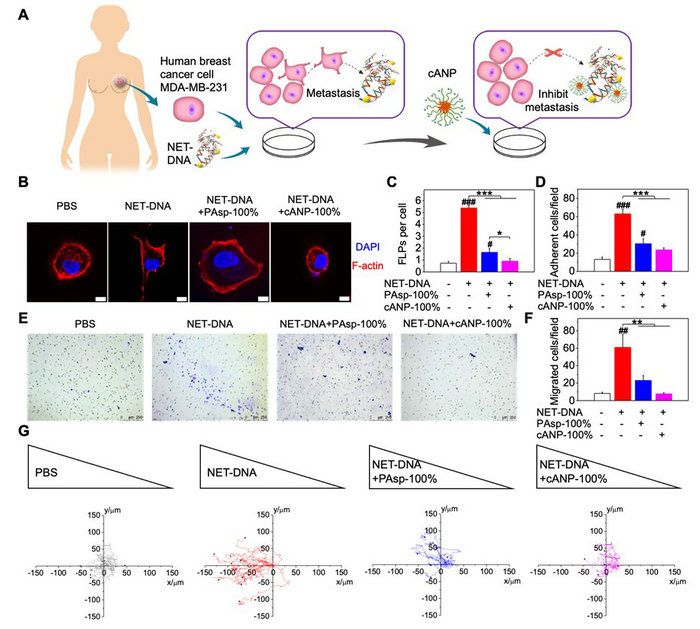
圖2. cANP 抑制人乳腺癌腫瘤細胞中由NET-DNA誘導的細胞趨化功能。(A)cANP通過結合NET-DNA抑制NET介導的人乳腺癌細胞轉移的示意圖;(B-C)陽離子聚氨基酸材料中和NET-DNA抑制NET-DNA誘導的癌細胞骨架變形(B-C)、癌細胞粘附(D)、癌細胞遷移(E-F)與癌細胞趨化能力(G)。
相較于PAsp-100%而言,納米顆粒 cANP-100%在肝臟有更多的富集量。因此,cANP-100%可更有效地中和并破壞導致腫瘤轉移至肝臟器官的NET-DNA,同時降低體內循環中NET-DNA的含量,使得其他易發生轉移的器官如肺部也有更低含量的NET積累(圖3)。
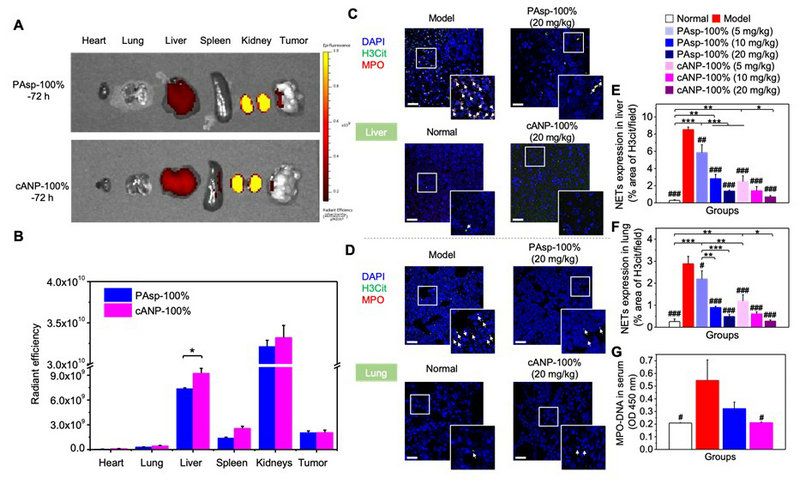
圖3. 在肝臟有更好積累的cANP能更好地減少小鼠原位乳腺癌模型局部NET的浸潤以及血清中NET-DNA的含量。(A-B)72小時PAsp-100%與cANP-100%在體內的分布情況;(C-F)不同組別中NET在乳腺癌模型肝臟(C, E)和肺部(D,F)的浸潤情況;(G) 血清中MPO-DNA的濃度。
憑借著優良的DNA結合能力與肝積累的能力,cANP-100%比PAsp-100%更好地抑制了體內腫瘤細胞向肝臟及肺部的轉移。在4T1小鼠乳腺癌原位腫瘤模型、HCT116人結腸癌轉移瘤模型以及MDA-MB-231人乳腺癌原位腫瘤模型中,cANP-100%都更有效減少肝臟和肺部的腫瘤結節數,降低了腫瘤細胞在這些遠端器官的浸潤。值得一提的是cANP-100%的治療還有效延長了MDA-MB-231人乳腺癌原位瘤模型的壽命,顯著提高了生存率,這在臨床上具有很大現實意義(圖4)。
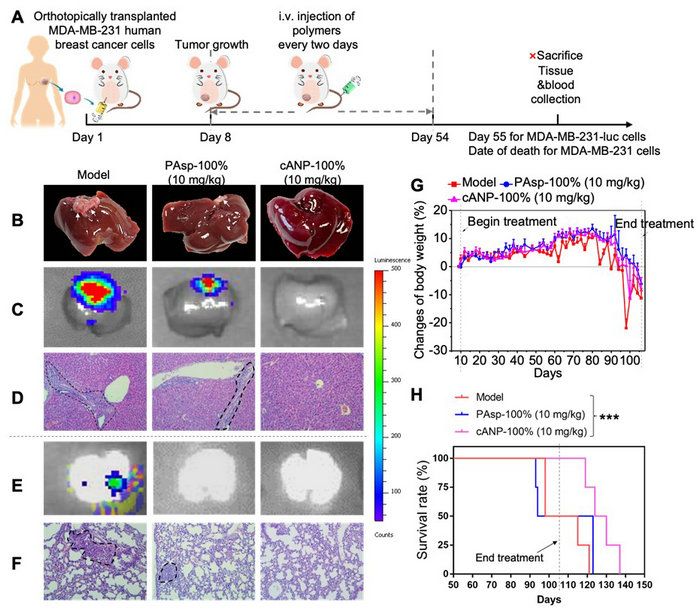
圖4. cANP-100%的治療有效減少MDA-MB-231人乳腺癌原位模型中癌細胞的肝轉移和肺轉移。(A)MDA-MB-231原位乳腺癌模型的實驗流程圖;(B)cANP-100%的治療有效減少肝腫瘤結節數;(C)luminescence圖顯示cANP-100%有效抑制MDA-MB-231-luc腫瘤細胞向肝臟的遷移;(D)HE組織切片顯示cANP-100%治療后肝臟沒有明顯的腫瘤細胞浸潤;(E)luminescence圖顯示陽離子聚天冬氨酸材料都有效抑制MDA-MB-231-luc腫瘤細胞向肺部的遷移;(F)HE組織切片顯示cANP-100%組肺部沒有明顯的腫瘤細胞浸潤;(G)治療過程中小鼠的體重變化(H)cANP-100%的治療有效延長腫瘤小鼠的生存期。
這項工作揭示了聚氨基酸陽離子材料可以通過中和并清除NET-DNA,來阻斷NET-DNA介導的腫瘤轉移。其中納米顆粒化的材料cANP有更好的肝臟聚集效果和結合DNA能力,可更好地降低肝臟的NET-DNA水平,從而減少了腫瘤細胞向肝臟的轉移。同時cANP也降低了血液中NET-DNA和其他容易發生轉移的器官如肺部的NET-DNA水平,從而抑制這些器官中的腫瘤轉移。需要強調的是,這個治療理念也在人源乳腺癌原位移植模型中得到證實,并體現出延長癌癥小鼠生存期的效果。該研究通過合成的聚氨基酸材料清除趨化因子NET-DNA來阻斷癌癥轉移的秘密通道,為抑制腫瘤的遠端轉移提供了簡單、安全、高效的新策略。
該研究成果以“Nanoparticulate cationic poly(amino acid)s block cancer metastases by destructing neutrophil extracellular traps”為題目,于2023年1月17日發表在國際學術期刊ACS Nano。中山大學博士研究生梁慧怡、杜逸博為第一共同作者,劉利新教授、陳永明教授為共同通訊 作者。中山大學材料科學與工程學院為論文第一完成單位。該研究工作得到國家自然科學基金資助。