
中大新聞網訊(通訊員元少春)細胞焦亡是由Gasdermin(GSDM)蛋白介導的一種炎性細胞死亡方式。一般情況下,GSDM蛋白的N端和C端處于自抑制狀態。當細胞感知病原如細菌或其它的危險信號后,GSDM可被Caspase、Granzyme等多種水解酶切割活化,釋放其具有成孔活性的N端肽段,通過膜成孔的方式誘導細胞焦亡,促進IL-1b、DAMPs等促炎介質的釋放。哺乳動物GSDM家族包含PJVK, GSDMA/B/C/D/E六個成員,其功能及調控多樣性與病原感染,腫瘤及自身免疫性疾病等的發生發展息息相關。無脊椎動物僅有GSDME一個成員,有研究報道早在刺胞動物中,GSDME即可以介導細胞焦亡,并參與抗菌免疫。然而,在無脊椎動物向脊椎動物過渡的階段,GSDME的功能特征,及其對GSDM家族系統演化的影響尚不清楚。
5月3日,生命科學學院徐安龍/元少春團隊追溯了GSDM蛋白家族的演化歷程,并揭示了脊椎動物祖先GSDME介導的細胞焦亡的調控復雜性。
該研究首先利用基因共線性分析和內含子相位分析等手段梳理了物種間GSDM家族成員在基因數目、基因組組成等方面的特點,推測GSDM家族的形成可能是宿主與病原互相博弈的結果。隨后,作者以被譽為脊椎動物祖先的“活化石”——文昌魚為研究對象,發現文昌魚GSDME(BbGSDME)可被多種Caspase在V250HTD253和D301VVD304兩個位點進行切割,從而產生N253(p30)和N304(p40)兩個功能不同的N端肽段。通過構建細菌感染模型,作者證明了特異性底物小肽(Ac-VHTD-CHO)可抑制N253的生成,并緩解文昌魚因細菌感染而引起的肌肉壞死等癥狀。通過該研究,作者還揭示了BbGSDME存在復雜的調控方式以維持機體穩態,主要包括:(1)BbGSDME在轉錄水平受到了BbIRF1/8的調控;(2)BbGSDME存在多種可選擇性剪接體及較高的個體單核苷酸多態性;(3)BbGSDME-N304及N253可由相同的Caspase切割產生。N304通過與N253結合,抑制其膜定位,從而延緩由N253介導的細胞焦亡。最后,作者通過結合演化及功能分析,發現了數個可影響人類GSDME活性的關鍵氨基酸位點,揭示了細胞焦亡在脊椎動物祖先中既保守又獨特的調控機制。該研究幫助我們進一步理解了GSDM家族與病原博弈的演化歷程,也為人類GSDM功能的復雜調控從演化的角度提供了新的見解。
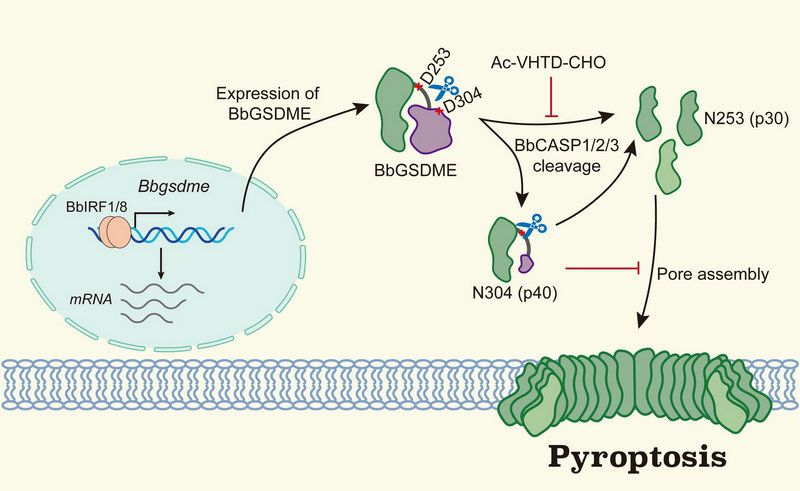
圖1 文昌魚GSDME介導的細胞焦亡
近日,該研究以“Characterization of GSDME in amphioxus provides insights into the functional evolution of GSDM-mediated pyroptosis”為題在PLoS Biology雜志上發表。中山大學生命科學學院為第一署名單位。該研究得到了國家重點研發計劃“藍色糧倉科技創新專項”、國家自然科學基金等項目的資助。在論文發表的同期,美國康涅狄格大學Jianbin Ruan教授為該論文撰寫了題為“An ancient defense mechanism: Conservation of gasdermin-mediated pyroptosis”的導讀(Primer),對該研究工作進行點評。