
中大新聞網訊(通訊員李丹丹)2023年6月10日,中山大學腫瘤防治中心徐瑞華教授、張曉實教授團隊在Nature communications上在線發表題為“一項關于外周血單個核細胞來源的新抗原特異性CD8+T細胞治療晚期實體瘤患者清淋強度的初步研究”。該研究是一項探究新抗原特異性CD8+T細胞(Neo-T)治療標準治療難治性局部晚期或轉移性實體瘤的清淋方案的單臂、開放、非隨機Ⅰ期研究。研究結果顯示,無清淋預處理的Neo-T療法可能是治療晚期實體瘤的一種安全、有前景治療方案。
過繼性T細胞療法(adoptive T cell therapy,ACT)正在成為晚期腫瘤患者有前景的治療選擇。這些過繼細胞包括嵌合抗原受體(CAR) T 細胞、T 細胞受體(TCR)T 細胞和腫瘤浸潤淋巴細胞(TIL)。多項臨床研究表明,新抗原特異性腫瘤浸潤淋巴細胞(TIL)的過繼轉移可以介導幾種實體腫瘤的持久消退。然而,收集TIL需對腫瘤組織進行侵入性取樣,且通常受到切除腫瘤組織尺寸相對較小的限制,此外,某些腫瘤部位難以取樣。最近,有研究報道稱,在腫瘤患者外周血中發現了可識別新抗原的T細胞克隆。并且外周血淋巴細胞(peripheral blood lymphocyte,PBL)中的T細胞可識別新抗原P53,如同TILs。因此,本研究推測PBL可能成為獲取T細胞的可靠且無創的來源,用于開發靶向新抗原ACT療法來治療腫瘤患者。
非清髓性清淋化療常用于ACT之前以抑制宿主免疫系統,降低免疫原性,從而提高IL2,IL7,IL15等的可用性,減少調節性T細胞(Treg),并增加回輸T細胞的持久性。氟達拉濱和環磷酰胺是清淋化療最常用的藥物。然而,清淋也會引起神經毒性、中性粒細胞減少、貧血和感染風險增加等不良反應。目前,清淋的給藥強度在不同的中心和臨床試驗中差異較大,并且每個T細胞產品都有各自特有的清淋方案,尚缺乏標準清淋方案。
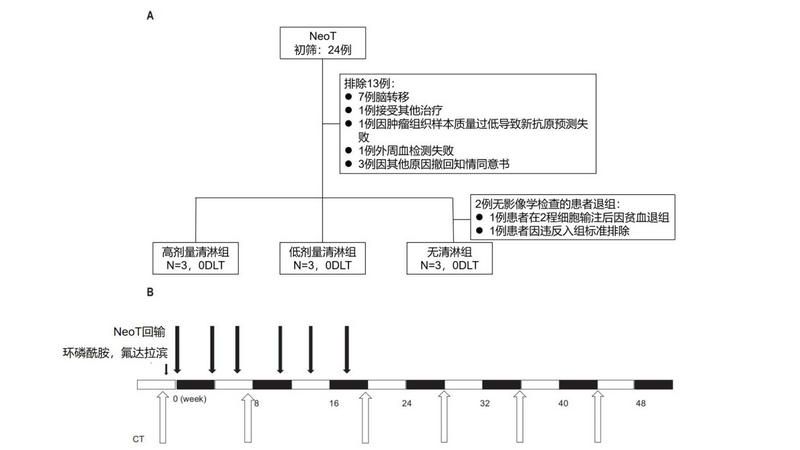
研究過程圖示
在本研究中,研究者開發了一種從患者外周血單核細胞中產生個性化Neo-T(新抗原特異性CD8+T細胞)的方法。首先,建立了一個管道,包括通過生物信息學分析進行新抗原預測,并在25天內對T細胞大規模擴增特異性新抗原。為了評估Neo-T治療的臨床療效并確定Neo-T治療時的最佳清淋強度,研究者以氟達拉濱和環磷酰胺劑量遞增的方式對Neo-T療法進行了首次人體研究。本研究共納入了11例標準治療難治性局部晚期或轉移性實體瘤患者,按照入組時間分為三個治療組:無LD化療預處理組、低強度LD化療預處理組和高強度LD化療預處理組。
研究結果顯示,所有入組患者的PBMC均成功產生Neo-T,并可成功識別幾種預測的新抗原。盡管Neo-T治療輸注劑量相對較小(4.78E7-9.0E8),但仍展現出有希望的客觀緩解率(33%),與輸注T細胞數量為1E10-1E11的TIL/TCR-T療法療效相當。出乎意料的是,無清淋化療預處理組的患者臨床反應最佳。
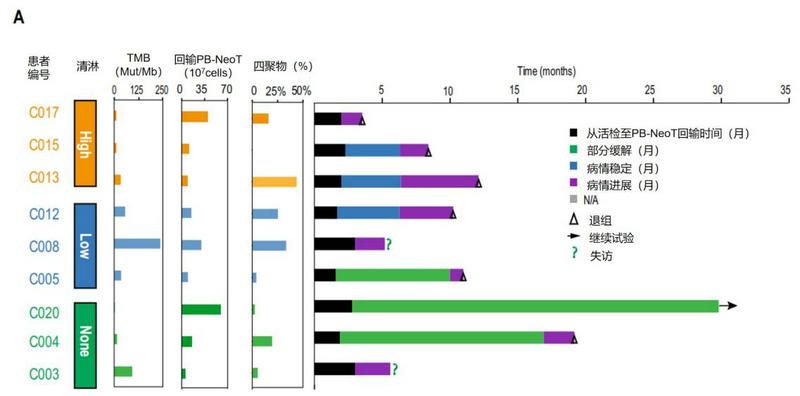
三個治療組研究結果對比
在安全性方面,最常見的不良反應包括貧血、淋巴細胞減少、蛋白尿、瘙癢、皮疹、竇性心動過速等。3-4級不良反應多發生于低強度LD化療預處理組和高強度LD化療預處理組,最常見是淋巴細胞減少。未發生急性不良事件,總體而言,安全性良好。
綜上,本研究表明,經由腫瘤患者外周血制備個性化Neo-T過繼轉移治療過程中,不同的清淋化療劑量耐受性良好,安全可控。并且在無清淋化療預處理情況下仍能夠介導持久的腫瘤消退。
中山大學腫瘤防治中心徐瑞華教授、張曉實教授以及深圳華大基因研究院張曦研究員為該研究論文的共同通訊作者。中山大學腫瘤防治中心李丹丹副主任醫師、李婧婧副主任醫師、丁婭副主任醫師及深圳華大基因研究院陳超、岳建輝、王海倫為共同第一作者。