
中大新聞網訊(通訊員匡銘)近日,中山大學附屬第一醫院肝膽胰外科中心匡銘教授團隊與精準醫學研究院劉純研究員、王驥研究員團隊合作在Cell Reports Medicine上發表了研究成果“Mechanical Confinement Promotes Heat Resistance of Hepatocellular Carcinoma via SP1/IL4I1/AHR Axis”,首次構建基于3D打印的肝癌熱消融模型,揭示了機械應力促進肝癌細胞熱抵抗并介導消融后復發的相關機制。
盡管熱消融術是早期肝癌(HCC)的根治性治療手段,但其術后復發仍是目前面臨的主要臨床難題,這表明部分腫瘤細胞在高溫熱應激下具備更強的熱抵抗。腫瘤3D微環境中的機械應力能在極端條件下決定細胞命運,而目前傳統的2D和動物消融模型難以對機械應力進行深入的機制探討。因此,需要構建高度模擬體內的3D熱消融模型,從3D機械應力的角度為防治HCC熱消融后復發提供新輔助療法的臨床轉化方案。
研究人員開發了一種基于3D生物打印的熱消融模型,高保真地模擬了熱消融時的連續熱場分布以及細胞熱應激狀態,實現了更精確的熱消融溫度控制與監測,用于研究腫瘤細胞在真實3D環境下的熱相關生物學行為。對比2D模型,HCC細胞在3D環境中展現出更強的熱抵抗能力。
機制研究發現,3D環境中的機械應力驅動了HCC細胞的代謝適應,并決定了HCC細胞在熱消融極端溫度下的命運。結合多種熱消融模型與臨床樣本,研究人員發現3D環境中的機械應力會導致細胞核形變,提示HCC患者消融后的不良預后。機械應力會促進轉錄因子SP1磷酸化水平上調以及IL4I1啟動子位點的染色質開放性,介導IL4I1在3D環境中的轉錄水平增加。IL4I1能促進色氨酸代謝產物I3A和KynA的生成,從而激活下游的芳烴受體(AHR)信號通路,促進HCC熱抵抗以及熱應激后生長、侵襲和轉移。最后,研究人員證實靶向阻斷AHR信號通路能抑制3D環境中HCC細胞的熱抵抗,從而抑制HCC熱消融后腫瘤進展。
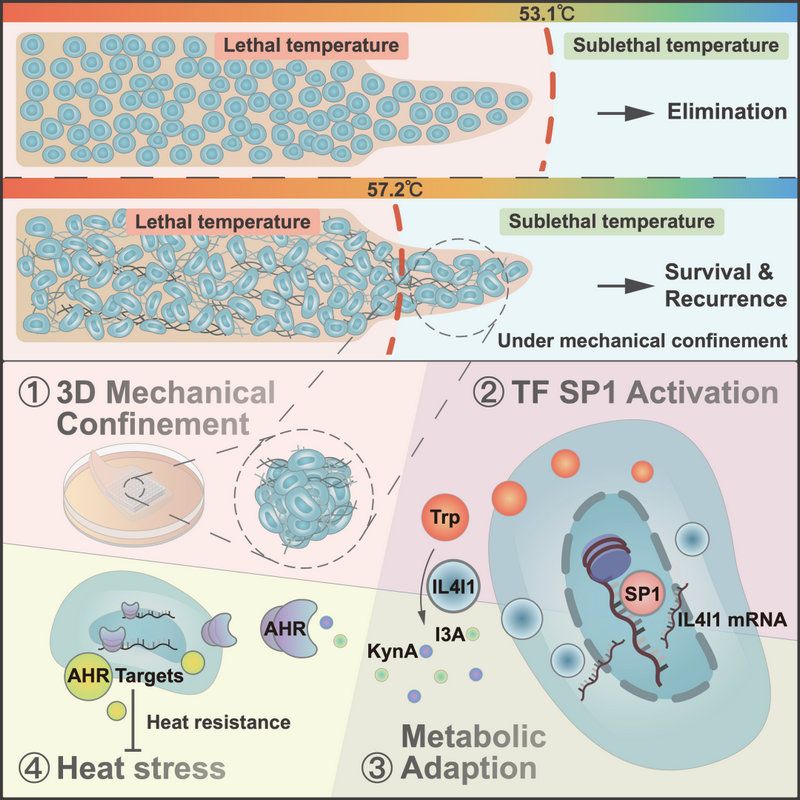
3D環境中的機械應力促進HCC消融后復發的機制。3D環境的機械應力促進SP1活化,進而上調IL4I1的表達,IL4I1介導的色氨酸代謝產物I3A和KynA通過激活下游AHR通路導致熱抵抗,促進HCC消融后進展。
該研究構建了一種基于3D生物打印的熱消融模型,為研究3D環境下的熱相關分子機制提供了新的系統性工具,鑒定出機械應力激活的SP1/IL4I1/AHR軸在HCC消融后進展發揮著重要作用,為通過靶向抑制AHR通路提高熱消融療效提供了理論依據。中山大學附屬第一醫院肝膽胰外科中心博士生張國培是該論文的第一作者,腫瘤科博士生謝宗林和精準醫學研究院博士生蔣娟是共同第一作者,肝膽胰外科中心匡銘教授是最后通訊作者,精準醫學研究院劉純研究員和王驥研究員是共同通訊作者。
論文鏈接:https://doi.org/10.1016/j.xcrm.2023.101128