
中大新聞網(wǎng)訊(通訊員張婷婷、戴希安、簡文楊)近日,附屬第六醫(yī)院胃腸病學研究所李孟鴻教授及其合作團隊在Advanced Science(2022IF=15.1)雜志上發(fā)表了題為 “CSN6-SPOP-HMGCS1 Axis Promotes Hepatocellular Carcinoma Progression via YAP1 Activation” 的研究論文。該研究發(fā)現(xiàn)COP9信號小體亞基6 (CSN6) 通過拮抗斑點型POZ蛋白 (SPOP) 泛素連接酶穩(wěn)定HMGCS1,進而激活YAP1促進腫瘤的生長,為靶向腫瘤代謝異常的精準治療提供了新思路。
目前,肝癌是一個全球性的健康問題,其發(fā)病率和死亡率在世界范圍內(nèi)不斷上升,其中,肝細胞癌 (Hepatocellular carcinoma, HCC) 是最常見的肝癌形式,大約占肝癌總病例數(shù)的90%。超過90%的HCC病例發(fā)生在有慢性肝病的背景下,任何造成肝硬化的病因都是HCC的危險因素,主要包括乙肝或丙肝病毒感染、慢性飲酒、糖尿病或肥胖相關(guān)的非酒精性脂肪肝病(Non-alcoholic fatty liver diseases, NAFLD) 等。隨著肥胖的流行,NAFLD預計將成為未來HCC的主要原因,而膽固醇升高是NAFLD相關(guān)癌癥的重要指標之一,膽固醇由乙酰輔酶A經(jīng)過30步酶促反應(yīng)合成,即甲羥戊酸 (MVA) 合成途徑。研究靶向膽固醇合成途徑,有利于發(fā)現(xiàn)更加安全有效的NAFLD相關(guān)HCC的治療方案與策略。
研究團隊采用大數(shù)據(jù)進行聯(lián)合肝癌組織微陣列免疫組化分析,發(fā)現(xiàn)CSN6在腫瘤組織中表達上調(diào)且與病人生存率低顯著相關(guān)。進一步,采用CRISPR-Cas9基因編輯系統(tǒng)構(gòu)建肝臟特異性CSN6基因敲除小鼠,通過構(gòu)建原位肝癌自發(fā)模型,研究團隊發(fā)現(xiàn)肝臟特異性敲除CSN6可抑制肝臟腫瘤生長,并降低小鼠血液膽固醇水平,這提示CSN6在肝癌發(fā)生發(fā)展中發(fā)揮重要作用。
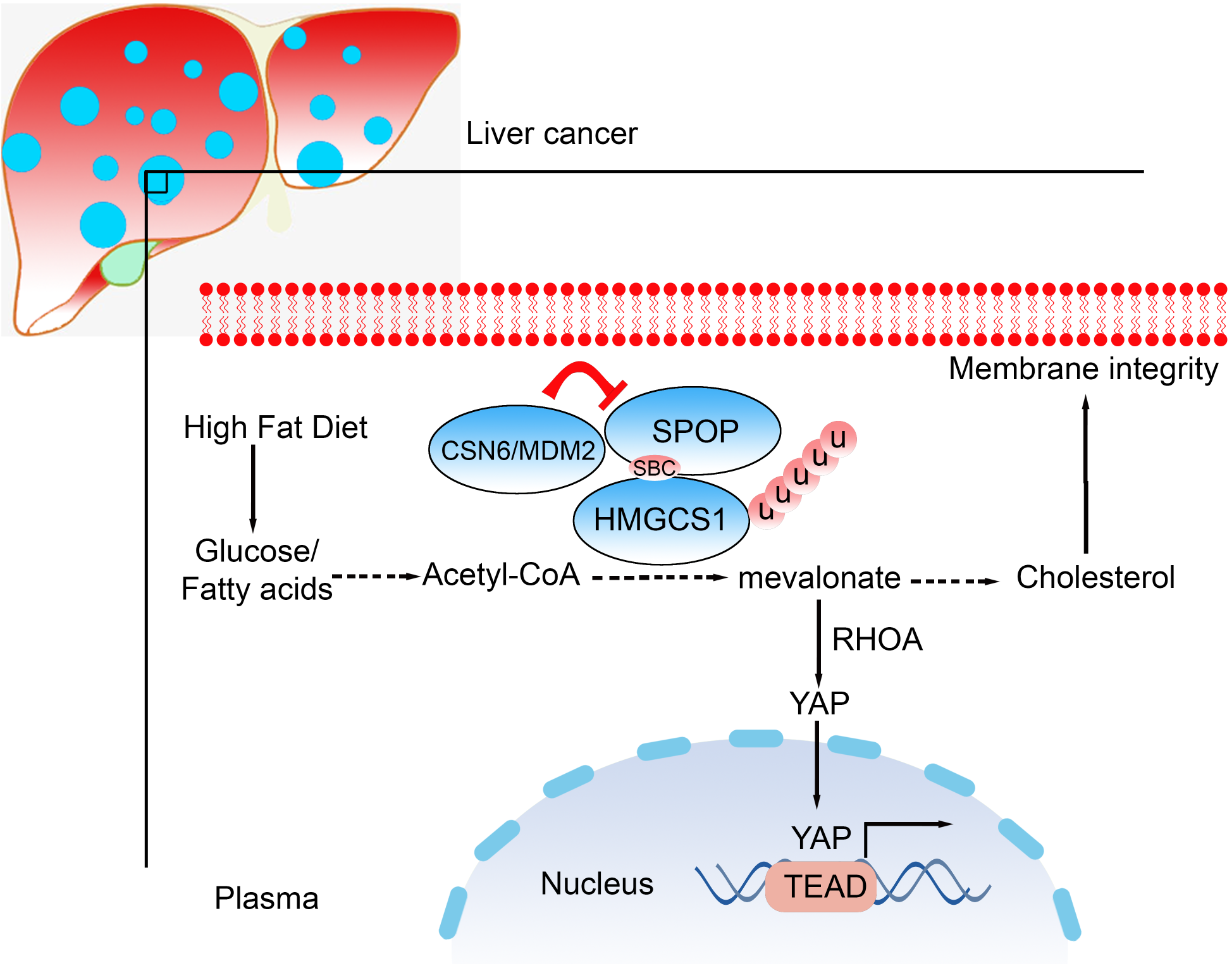
為了闡明CSN6在肝癌中的作用機制,研究團隊通過免疫共沉淀質(zhì)譜和定量蛋白質(zhì)組學分析,確定了68個潛在的CSN6直接作用靶點,并發(fā)現(xiàn)CSN6直接結(jié)合并調(diào)控HMGCS1(MVA合成相關(guān)途徑關(guān)鍵酶,催化乙酰乙酰輔酶A,生成β-羥基-β-甲基戊二酰輔酶A(HMG-CoA))的蛋白質(zhì)水平。進一步,發(fā)現(xiàn)CSN6可以調(diào)節(jié)MDM2的穩(wěn)定性,從而破壞E3連接酶SPOP的穩(wěn)定性,對抗SPOP介導的HMGCS1的泛素化和降解過程。因此,CSN6調(diào)控HMGCS1蛋白的穩(wěn)定性,進而促進MVA途徑和YAP1的轉(zhuǎn)錄激活,從而促進腫瘤的惡性進展。本研究第一次鑒定兩個知名E3連接酶MDM2和SPOP之間存在相互調(diào)控,發(fā)現(xiàn)MDM2為知名抑癌基因SPOP的E3連接酶,提示SPOP除了在腫瘤突變之外,其低表達也是誘發(fā)腫瘤的重要因素之一。
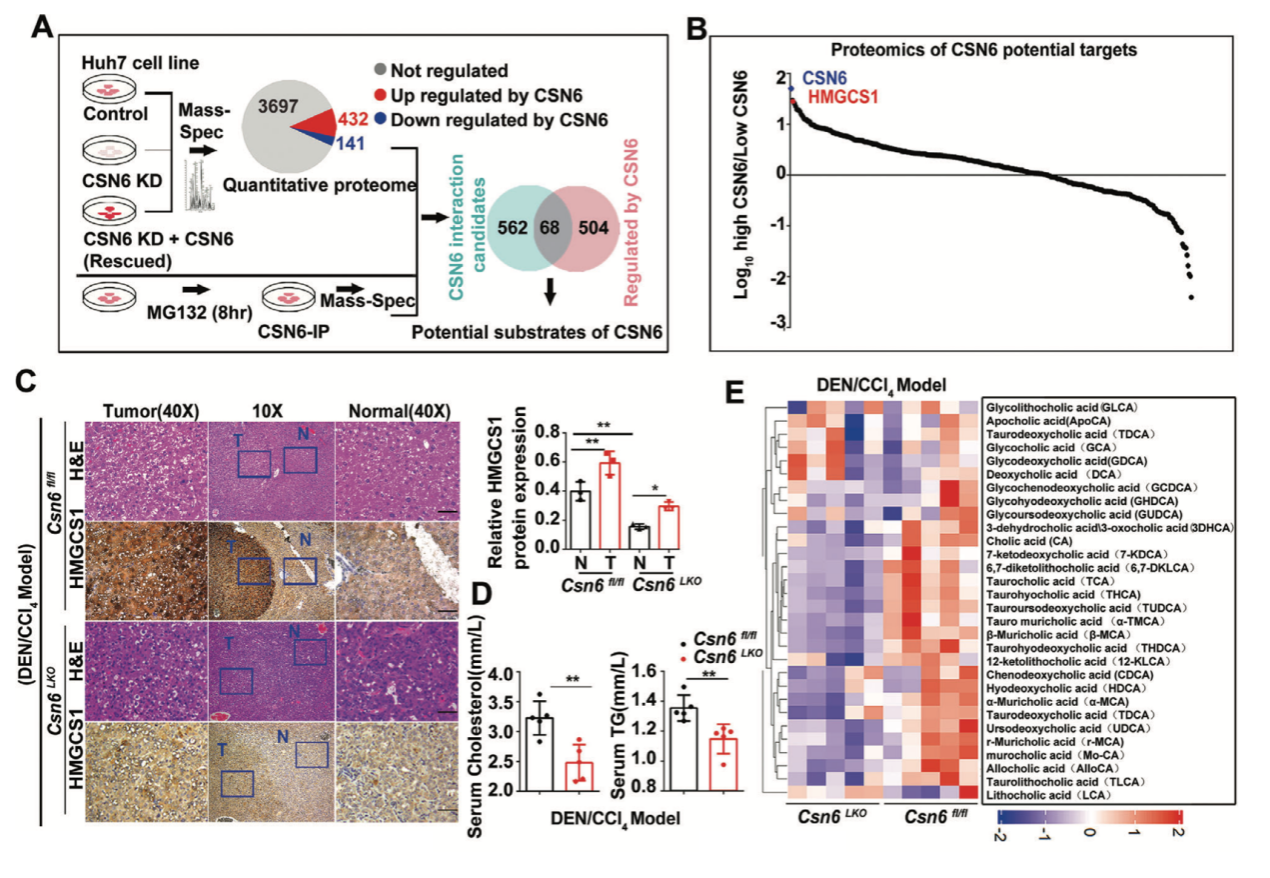
最后,研究團隊構(gòu)建了患者來源的腫瘤異種移植模型,發(fā)現(xiàn)在CSN6高表達的腫瘤中, 靶向抑制HMGCS1提高了YAP1抑制劑的療效。該研究確定了CSN6-HMGCS1-YAP1軸在介導HCC發(fā)生發(fā)展中的關(guān)鍵作用。
綜上,該研究通過臨床組織芯片,基因敲除小鼠和蛋白質(zhì)組學等手段,鑒定了肥胖以及NAFLD相關(guān)肝癌發(fā)生發(fā)展的分子機制,解釋了脂代謝異常與肝癌進展的潛在原因,為NAFLD相關(guān)HCC患者的臨床治療提供了潛在的指導策略與方法。
本論文通訊作者為中山大學附屬第六醫(yī)院教授李孟鴻、暨南大學醫(yī)學院教授張海鵬和中山大學腫瘤防治中心教授周仲國,第一作者為中山大學附屬第六醫(yī)院副研究員李凱、博士后張家毓、博士研究生呂海文和碩士研究生楊金能。本研究得到了國家重點研發(fā)計劃和國家自然科學基金等項目資助。
論文鏈接:https://doi.org/10.1002/advs.202306827