
中大新聞網(wǎng)訊(通訊員彭飛)合成微/納馬達是一種微型化裝置,可以通過轉(zhuǎn)換外部能量或化學(xué)燃料轉(zhuǎn)化為自主運動,用于靶向給藥、體內(nèi)成像和微創(chuàng)手術(shù)等。中山大學(xué)材料科學(xué)與工程學(xué)院彭飛副教授團隊提出,還可以將微納米馬達作為一種與神經(jīng)系統(tǒng)通信的新方式。
通過Ni-Zn微馬達信號傳導(dǎo)誘導(dǎo)神經(jīng)干細胞定向分化
神經(jīng)干細胞具有自我更新、分化和環(huán)境調(diào)節(jié)的能力,被認為在中風、腦損傷治療和神經(jīng)元再生方面很有前景。內(nèi)源性神經(jīng)干細胞的激活,吸引著越來越多的研究熱情,避免了免疫排斥和外源性細胞移植的倫理問題。然而,如何在原位誘導(dǎo)定向生長和分化仍然是一個主要的挑戰(zhàn)。
彭飛副教授團隊提出了一種基于自建立的電化學(xué)場的非侵入性純水驅(qū)動的Ni-Zn微馬達(圖1a)。在Zn端,H+被還原生成H2和Zn2+。Zn2+的逐漸積累產(chǎn)生了濃度梯度和驅(qū)動Ni-Zn微馬達的自構(gòu)造電場。有趣的是,與以前的化學(xué)驅(qū)動微馬達相比,Ni-Zn微馬達在運動過程中沒有產(chǎn)生氣泡,從而避免了氣體栓塞。微馬達可以磁引導(dǎo)和精確接近目標神經(jīng)干細胞,在定位和可控性方面具有獨特的優(yōu)勢。水驅(qū)動的Ni-Zn微馬達在運動過程中產(chǎn)生Zn2+。Zn2+場和電壓門控Ca2+通道的激活,導(dǎo)致細胞內(nèi)Ca2+的短暫變化,從而激活后期神經(jīng)干細胞的分化。接近電池后,由于馬達自身Zn端到Ni端的濃度梯度,在單個馬達上形成自構(gòu)造的電場。神經(jīng)干細胞受到Ni-Zn微馬達電場的影響,產(chǎn)生生物電信號,這是誘導(dǎo)神經(jīng)干細胞分化的一個因素。Zn2+還具有促進干細胞增殖、神經(jīng)發(fā)生和神經(jīng)元分化的作用。因此,我們有理由認為,微馬達釋放的Zn2+對維持神經(jīng)干細胞中的Zn2+穩(wěn)態(tài)具有重要意義。因此,微馬達通過電化學(xué)場,允許生物電信號與內(nèi)源性神經(jīng)干細胞進行交換和通訊,從而允許在體內(nèi)調(diào)節(jié)神經(jīng)元增殖和定向分化(圖1b)。因此,該研究開發(fā)了一種結(jié)合電和化學(xué)效應(yīng)的非侵入性和持久的神經(jīng)刺激系統(tǒng)。它使與神經(jīng)干細胞再生和分化相關(guān)的信號通路能夠得到持久的激活。有針對性和持久的效果,同時避免嚴重的術(shù)后創(chuàng)傷和并發(fā)癥。
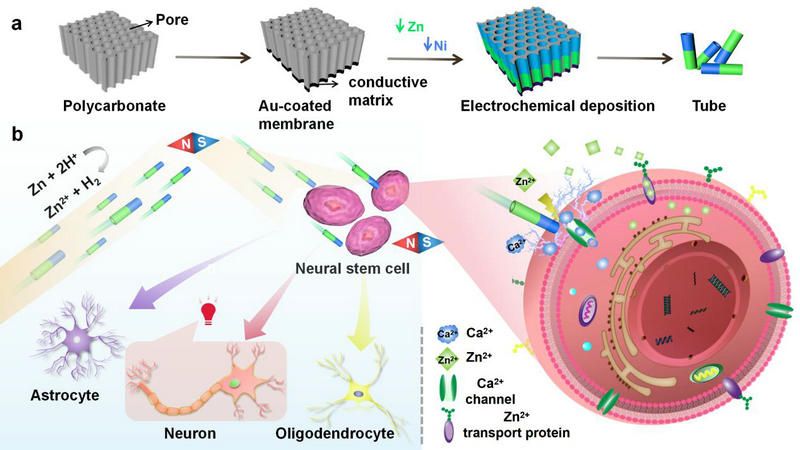
圖1 Ni-Zn微馬達的制備及靶向激活神經(jīng)干細胞和引導(dǎo)細胞分化的示意圖
該工作題為“Directed Neural Stem Cells Differentiation via Signal Communication with Ni-Zn Micromotors”,發(fā)表于Advanced Materials。中山大學(xué)材料科學(xué)與工程學(xué)院2021級博士研究生封燁為獨立第一作者,中山大學(xué)材料科學(xué)與工程學(xué)院彭飛副教授為通訊作者。
納米機器人介導(dǎo)的同步神經(jīng)元激活
在自然界中,從細菌菌落到魚群,再到哺乳動物群體,生物可以聚集在一起形成群體并呈現(xiàn)大規(guī)模的集體行為。這些集體群體的例子很有吸引力,獨立的個體群體通過通信構(gòu)建了比自己大幾個數(shù)量級的復(fù)雜結(jié)構(gòu)。這種信息交換可以表現(xiàn)為包括振蕩在內(nèi)的群體模式。操縱神經(jīng)元振蕩和探索信息交換是非常有趣的,這可以為腦科學(xué)、人工智能和機器人技術(shù)提供啟示。但當下人工設(shè)計合成交互系統(tǒng)仍然是一個挑戰(zhàn)。
該團隊提出了振蕩納米機器人的程序化集群,其推進和集群背后的場信息作為體外與生物神經(jīng)元通信并觸發(fā)神經(jīng)振蕩的介質(zhì)。如圖2a所示,設(shè)計了一個由近紅外光驅(qū)動的高度可控的振蕩納米機器人群。納米機器人通過純水的光催化分解驅(qū)動電泳(并自建立的化學(xué)-電場梯度)。通過程序化的近紅外光照射,納米機器人群呈現(xiàn)周期性化學(xué)-電場和集體動態(tài)可逆收縮-膨脹-收縮(振蕩)行為。局部視網(wǎng)膜神經(jīng)節(jié)細胞(RGC)可以通過來自集群的振蕩電場有節(jié)奏地激活(圖2a ii和iii)。神經(jīng)元與編程的納米機器人集群節(jié)奏同步。有趣的是,在通過耦合振蕩使沒有物理接觸的神經(jīng)元群中觀察到同步周期性的波紋活動,類似于自然神經(jīng)系統(tǒng)中的振蕩網(wǎng)絡(luò)(圖2b)。共振允許原本無法到達毫米級外的神經(jīng)元信號得以傳輸,這不同于神經(jīng)元通常認為需要突觸直接連接和同步的方式。與數(shù)量有限的孤立神經(jīng)元相比,神經(jīng)元共振具有重要意義,因為大量同步神經(jīng)元群誘導(dǎo)下游神經(jīng)反應(yīng)的機會更高。節(jié)律神經(jīng)活動還允許在不同時間窗口(即節(jié)律周期的特定階段)進行神經(jīng)興奮性調(diào)節(jié),以便神經(jīng)元組可以通過鎖相神經(jīng)振蕩精確地相互作用。這代表我們的合成可編程振蕩平臺提供了與神經(jīng)元系統(tǒng)通信的新方式。
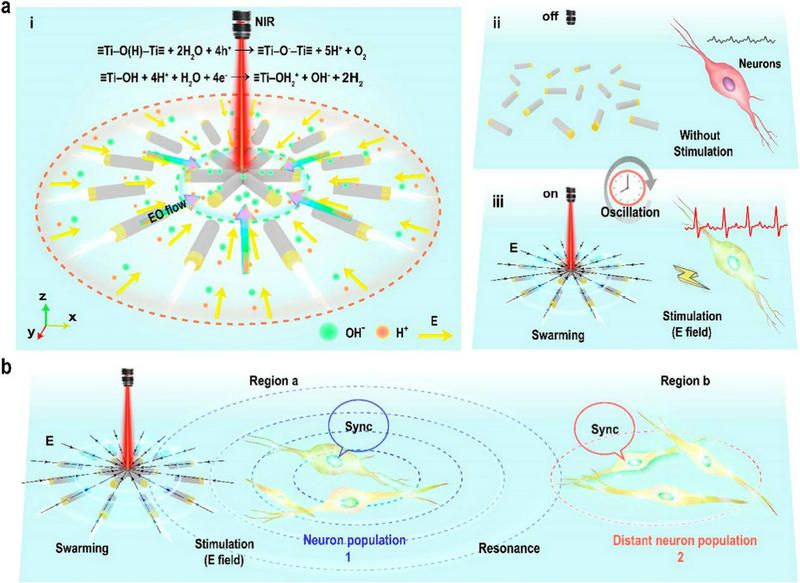
圖2 編序化NIR下的振蕩納米機器人集群和不同區(qū)域神經(jīng)元群的同步周期性漣漪的示意圖
該工作題為“Nanorobot-Mediated Synchronized Neuron Activation”,發(fā)表于ACS Nano。中山大學(xué)材料科學(xué)與工程學(xué)院2022級博士研究生陳彬為獨立第一作者,中山大學(xué)材料科學(xué)與工程學(xué)院彭飛副教授為通訊作者。
相關(guān)工作得到國家自然科學(xué)基金資助項目,廣東省杰出青年科學(xué)基金項目,國家重點研發(fā)計劃項目的支持。
論文鏈接: