
中大新聞網(wǎng)訊(通訊員彭福祥、章智琦)近日,中山大學(xué)附屬第一醫(yī)院精準醫(yī)學(xué)研究院彭穗教授團隊在Cancer Research雜志上發(fā)表了題為“Crosstalk between myeloid and B cells shapes the distinct microenvironments of primary and secondary liver cancer”的研究成果。
該研究首次從單細胞角度對原發(fā)性和繼發(fā)性肝癌中的免疫微環(huán)境進行了深入探討,揭示了不同類型的漿細胞與髓系細胞相互作用介導(dǎo)免疫抑制微環(huán)境的相關(guān)機制。
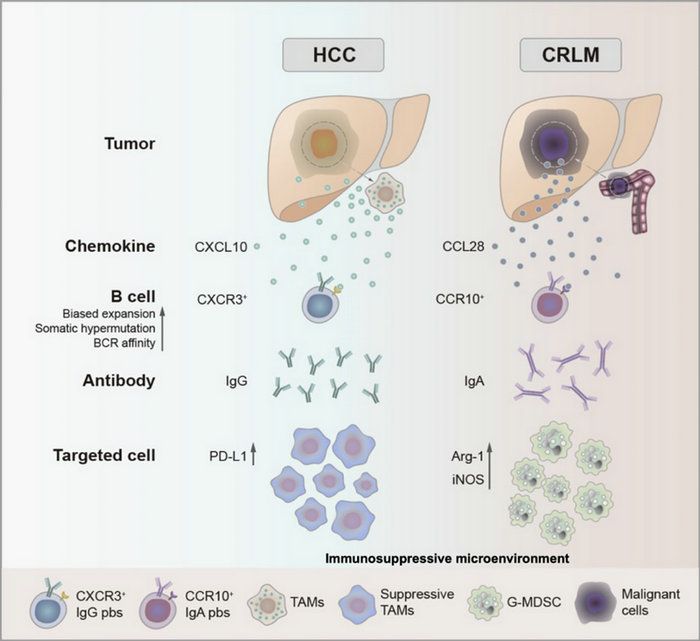
HCC中的IgG+漿細胞通過CXCR3-CXCL10軸被TAMs招募,而CRLM中的IgA+漿細胞通過CCR10-CCL28軸被腫瘤細胞招募,介導(dǎo)不同的免疫抑制作用
基于對腫瘤微環(huán)境(TME)的深入研究,免疫治療已在抗腫瘤治療領(lǐng)域取得了重大進展。然而,肝臟作為高度免疫耐受的器官,極大地限制了肝癌的免疫治療效果。肝癌根據(jù)器官起源可以分為原發(fā)性和繼發(fā)性肝癌,因此需要全面了解不同起源肝癌中TME的異質(zhì)性,為肝癌的免疫治療策略提供新的見解。
研究人員對61例原發(fā)性肝癌(HCC)和62例結(jié)直腸癌肝轉(zhuǎn)移(CRLM)樣本進行分析,證實了B細胞在HCC和CRLM微環(huán)境中發(fā)揮著的關(guān)鍵調(diào)節(jié)作用。通過單細胞測序?qū)?4250個B細胞進行深入剖析,研究發(fā)現(xiàn)IgG+漿細胞在HCC中顯著積累,而IgA+漿細胞則更傾向于在CRLM中富集。
研究人員進一步發(fā)現(xiàn),在機制上,HCC中的IgG+漿細胞通過CXCR3-CXCL10軸被腫瘤相關(guān)巨噬細胞招募,而CRLM中的IgA+漿細胞通過CCR10-CCL28信號被轉(zhuǎn)移性的結(jié)直腸癌細胞招募。在功能上,IgG+漿細胞在HCC中誘導(dǎo)促腫瘤巨噬細胞的分化,而IgA+漿細胞在CRLM中則趨向誘導(dǎo)粒細胞-髓源性抑制細胞(G-MDSC)的激活。在臨床上,HCC中IgG+漿細胞和巨噬細胞浸潤增加與較差的生存率相關(guān),而CRLM中IgA+漿細胞和中性粒細胞的富集則提示預(yù)后不良。
該研究首次從單細胞水平剖析HCC和CRLM中的漿細胞和髓系細胞介導(dǎo)免疫抑制的作用機制,表明有選擇地調(diào)節(jié)原發(fā)或繼發(fā)腫瘤相關(guān)的免疫抑制調(diào)控網(wǎng)絡(luò)可能重塑微環(huán)境,為治療肝癌提供了新的免疫治療策略。中山大學(xué)附屬第一醫(yī)院肝膽胰外科中心博士后陳志航是該論文的第一作者,精準醫(yī)學(xué)研究院彭穗教授是最后通訊作者,中山大學(xué)生命科學(xué)院鄺棟明教授是共同通訊作者。