
5月26日,中山大學腫瘤防治中心高嵩教授課題組在《Nature Communications》雜志上發表題為“Conformational Dynamics of Dynamin-like MxA Revealed by Single-molecule FRET” (文章鏈接:https://www.nature.com/articles/ncomms15744)的研究論文,報道了人類抗病毒蛋白MxA在作用過程中構象變化的情況,進一步明確了MxA的抗病毒作用機制。陳洋博士(2016年畢業于我校)為第一作者,高嵩教授為通訊作者。
MxA蛋白是人類先天免疫系統的重要效應蛋白,對多種RNA病毒有強烈的抵抗作用。MxA屬于dynamin蛋白家族,是一個含多個結構域的大型GTP酶。dynamin家族蛋白的功能依賴于自身多聚體的形成和解聚,其聚合狀態的改變主要是通過GTP水解過程中產生分子內部的構象變化來實現的。在水解GTP的過程中,MxA大致存在四種狀態,即游離態、GTP結合態、催化間態和GDP結合態。在以往的研究中,研究團隊通過結構生物學及相關的生物物理和生化手段解析了MxA莖部和游離態全長的晶體結構(Nature 2010, 465:502-6;Immunity 2011, 35:514-25),了解了MxA蛋白多聚的分子機理。然而全長MxA在其他狀態下的晶體結構一直尚未被解析,所以GTP水解對MxA分子構象變化的具體影響仍不十分明確。另一方面,MxA通過莖部形成多聚體的傾向造成其在非游離態的其他狀態下容易形成不規則的聚集體,是對其進行結構研究時面臨的最大困難。
高嵩教授課題組對MxA蛋白進行了多種修飾改造,經過不斷探索嘗試后成功獲得了功能基本不受影響的MxA蛋白單體,并利用X射線晶體衍射技術解析了單體MxA晶體結構。此后,高嵩課題組與中科院生物物理所趙永芳教授課題組合作,根據結構巧妙設計了一系列單分子熒光共振能量轉移的實驗,最終通過這種技術含量極高的生物物理技術在單分子水平上揭示了MxA蛋白在GTP水解過程中實時的構象變化情況。該研究闡明了MxA蛋白在抗病毒作用過程中結構改變的動態過程,有助于全面了解MxA抗病毒的具體分子機制,并對人們了解其他dynamin家族成員的具體作用方式有重要的啟發意義。
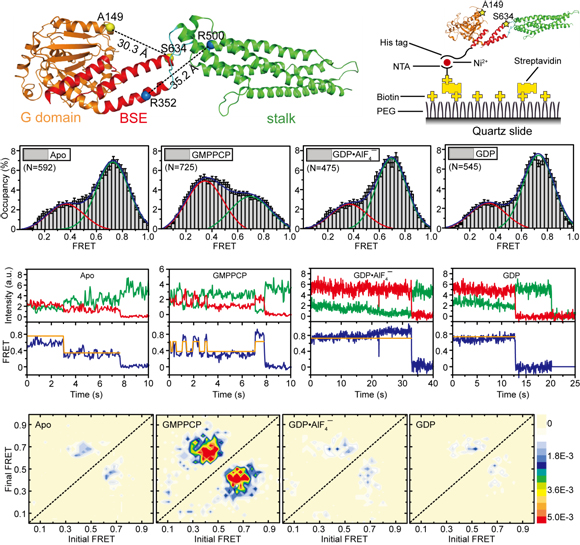
MxA單體的晶體結構和單分子構象動態變化
該研究工作的第一作者為陳洋博士和中科院生物物理所張磊博士。通訊作者是高嵩教授和中科院生物物理所趙永芳教授。德國弗萊堡大學的Kochs Georg教授和Graf Laura參與了該研究項目。X射線晶體衍射實驗是在上海光源完成的。項目獲得了國家自然科學基金、科技部973計劃、廣東特支計劃,以及華南腫瘤學國家重點實驗室等基金和單位的支持。