

孫逸仙紀(jì)念醫(yī)院乳腺腫瘤中心團(tuán)隊(duì)
9月17日,我校孫逸仙紀(jì)念醫(yī)院宋爾衛(wèi)教授、蘇士成副研究員團(tuán)隊(duì)的一項(xiàng)研究成果在線發(fā)表于《自然》子刊《自然·免疫學(xué)》雜志上。
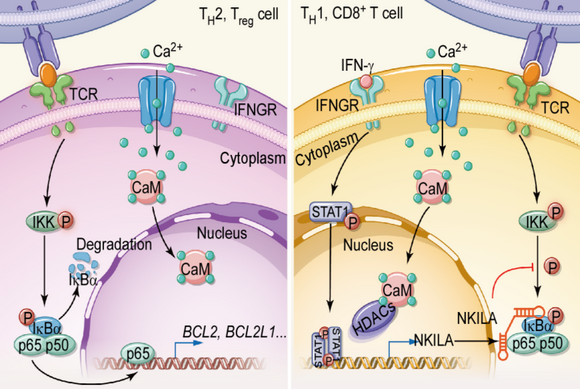
長(zhǎng)非編碼RNA NKILA調(diào)控不同亞群T細(xì)胞凋亡敏感性的機(jī)制
該研究發(fā)現(xiàn)了長(zhǎng)非編碼RNA NKILA能促使腫瘤特異T細(xì)胞被誘導(dǎo)凋亡,以至于不能開(kāi)“猛火”攻打腫瘤。研究還提示,可在體外將T細(xì)胞中的NKILA敲除,從而保證回輸?shù)襟w內(nèi)的T細(xì)胞的“火力”,增強(qiáng)免疫治療的效果。
免疫治療在2013、2017兩年被Science雜志評(píng)為十大年度科學(xué)突破。尤其在治療淋巴瘤、黑色素瘤等方面,免疫治療效果顯著。然而針對(duì)乳腺癌等實(shí)體腫瘤,免疫治療療效仍比較微弱,這說(shuō)明其中還有很多未知的機(jī)制需要進(jìn)一步探索。
宋爾衛(wèi)教授、蘇士成副研究員團(tuán)隊(duì)便針對(duì)他們擅長(zhǎng)的乳腺癌研究展開(kāi)了探索。他們發(fā)現(xiàn),腫瘤會(huì)“引誘”腫瘤特異T細(xì)胞對(duì)它“手下留情”。
這其中的內(nèi)在機(jī)制是什么?研究者發(fā)現(xiàn)了一個(gè)關(guān)鍵角色“長(zhǎng)非編碼RNA NKILA”。當(dāng)T細(xì)胞安靜時(shí)即還沒(méi)有激活時(shí),NKILA同樣很安靜,呈低表達(dá)的狀態(tài);然而,T細(xì)胞忙碌起來(lái)的時(shí)候,NKILA也開(kāi)始大量表達(dá)。
此刻,我們還要來(lái)認(rèn)識(shí)一條重要的“生死通路”——NF-κB通路。它激活時(shí)T細(xì)胞能抵抗腫瘤細(xì)胞的攻擊,從而打擊腫瘤。研究者發(fā)現(xiàn),NKILA一旦大量表達(dá),便會(huì)抑制NF-κB通路,那么T細(xì)胞的“火力”就會(huì)被大大減弱,腫瘤細(xì)胞也會(huì)“囂張”起來(lái)。
那么,該怎么用好這一系列機(jī)制呢?
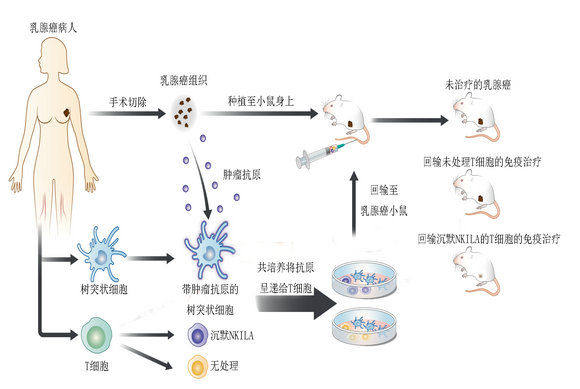
過(guò)繼性回輸沉默NKILA的T細(xì)胞在臨床前PDX模型中顯示療效
研究團(tuán)隊(duì)在體外對(duì)T細(xì)胞進(jìn)行了修飾,沉默了NKILA的表達(dá),再將T細(xì)胞回輸至患了乳腺癌的小鼠模型體內(nèi),NF-κB通路便會(huì)維持在激活狀態(tài)。他們發(fā)現(xiàn),如此一來(lái)腫瘤內(nèi)的T細(xì)胞明顯增多,被殺傷的腫瘤細(xì)胞增多,腫瘤明顯縮小。
9月17日這項(xiàng)研究成果,以“NKILA LncRNA promotes tumor immune evasion by sensitizing T cells to activation-induced cell death”(《長(zhǎng)非編碼RNA NKILA 通過(guò)使T細(xì)胞對(duì)凋亡敏感促進(jìn)腫瘤的免疫逃逸》)為題在線發(fā)表于《自然》子刊《自然·免疫學(xué)》雜志上。
宋爾衛(wèi)教授說(shuō),目前依托孫逸仙紀(jì)念醫(yī)院免疫治療中心的平臺(tái),團(tuán)隊(duì)計(jì)劃開(kāi)展I期臨床研究,即初步對(duì)臨床藥理學(xué)及人體安全性評(píng)價(jià)試驗(yàn)。
“基于前期研究結(jié)果,我們會(huì)在體外敲除T細(xì)胞的NKILA,再將T細(xì)胞輸至腫瘤患者。我們有信心能讓T細(xì)胞更好地集中火力向腫瘤細(xì)胞‘開(kāi)炮’。”宋爾衛(wèi)說(shuō),和腫瘤細(xì)胞基因治療相比,這一方法是在體外修飾細(xì)胞,更可靠、安全。
論文鏈接:https://www.nature.com/articles/s41590-018-0207-y
宋爾衛(wèi)教授團(tuán)隊(duì)簡(jiǎn)介:
宋爾衛(wèi)教授帶領(lǐng)的乳腺腫瘤研究團(tuán)隊(duì),從臨床問(wèn)題出發(fā),將外科臨床和基礎(chǔ)研究結(jié)合起來(lái)。他在非編碼RNA和腫瘤微環(huán)境調(diào)控腫瘤轉(zhuǎn)移領(lǐng)域取得了多項(xiàng)突破性和系統(tǒng)性的成果。主要包括:1、系統(tǒng)研究了miRNA對(duì)腫瘤細(xì)胞可塑性的調(diào)控作用。2、發(fā)現(xiàn)lncRNA可作為信號(hào)分子調(diào)控NFκB的活性并影響腫瘤轉(zhuǎn)移,提出了lncRNA與蛋白質(zhì)結(jié)合的新模型。3、發(fā)現(xiàn)了人類巨噬細(xì)胞特有的趨化因子CCL18的受體,在此基礎(chǔ)上深入闡明了趨化因子及其受體組成的巨噬細(xì)胞-腫瘤細(xì)胞信號(hào)環(huán)路促進(jìn)腫瘤轉(zhuǎn)移的機(jī)制。4、發(fā)現(xiàn)了腫瘤微環(huán)境中一類特殊亞型的腫瘤相關(guān)成纖維細(xì)胞能誘導(dǎo)腫瘤細(xì)胞的化療耐受。由于團(tuán)隊(duì)的杰出成就,宋爾衛(wèi)教授被Springer出版社邀請(qǐng)主編《長(zhǎng)短RNA與腫瘤生物學(xué)》英文專著,擔(dān)任Cell出版社主辦的“功能RNA”國(guó)際會(huì)議大會(huì)共同主席,多次在國(guó)際會(huì)議報(bào)告或擔(dān)任分會(huì)場(chǎng)主席。這些表明他已成為國(guó)際上該領(lǐng)域有重要影響的學(xué)者。宋爾衛(wèi)教授帶領(lǐng)的乳腺腫瘤創(chuàng)新研究團(tuán)隊(duì)以第一或通訊作者發(fā)表SCI論文125篇,被SCI他引5000多次,其中13篇SCI他引超過(guò)100次。