
自然界存在許多性能優異的跨膜蛋白通道可以高速度和高選擇性使脂質雙層上的陽離子進行傳輸。受自然界的啟發,科學家們開發了模擬人工離子通道的簡化模型,以研究跨膜傳輸的驅動因素及其在藥物、生物材料開發方面的潛在應用。其中自然鉀離子通道蛋白除了鉀離子外不允許其他陽離子通過,呈現高的運載鉀離子速率和選擇性。這種高度選擇性是自然通道蛋白運輸效果的重要決定因素,因此,吸引了很多化學家的研究興趣。在已經報道的研究結果中,很多報道的人工鉀離子通道并未重視K+/Na+的高選擇性通過問題。通常來說,金屬陽離子選擇性是由陽離子脫水損耗的能量與離子得到補償的能量比值決定的。
我校化學學院Lehn功能材料研究所超分子化學與材料方向外籍專家Mihail Barboiu教授長期致力冠醚衍生物協助離子傳輸的放生化學研究,近期報道了一系列高選擇性鉀離子通道(J. Am. Chem. Soc. 2006, 128, 9541-9548; Angew. Chem. Int. Ed. 2015, 54, 14473-14477; J. Am. Chem. Soc. 2016, 138, 426-432; J. Am. Chem. Soc. 2017, 139, 3721-3727;Angew. Chem. Int. Ed., 2018, 57, 10520-105)。
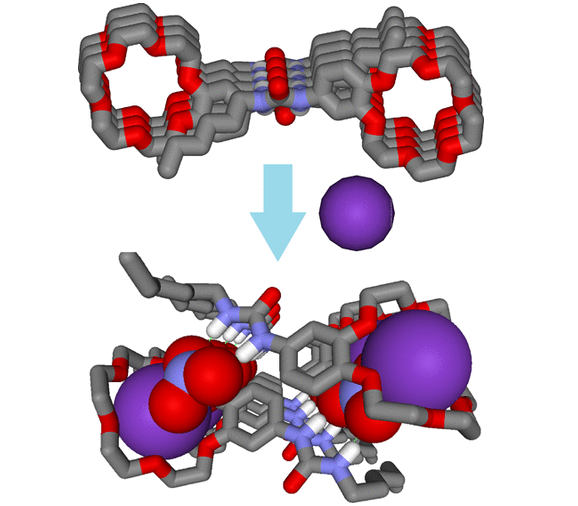
冠醚衍生物通過自身攜帶的大環識別位點,高選擇性地與鉀離子配位,協助鉀離子傳輸
結合上述研究及國內外同行研究成果,Mihail Barboiu教授總結了過去10年來跨膜傳輸鉀離子的人工通道蛋白的最新進展,綜述了人工鉀離子通道或運輸載體選擇性設計及其功能特性,特別是選擇性運輸鉀離子的功能設計,有助于進一步探究活性結構作為“過濾器”或“門控”蛋白在離子傳輸過程中的動態過程。綜述指出人工鉀離子通道一般具有以下特征:(i)鉀離子結合的大環識別位點。配位后大環通道獲得的能量可以補償鉀離子脫水后能量損耗。即使體系中存在過量的Na+離子,大環通道也只識別K+離子。從機理上看,該識別系統具有協同動態效應,K+離子的增加也協同驅使著大環通道對鉀離子的選擇性增大;(ii)能夠實現分子間自組裝的氫鍵供體與受體;(iii)具有可以嵌入疏水雙層膜結構的疏水鏈。
該綜述分析和總結了該類材料體系中跨膜傳輸鉀離子的機理與機制;總結了人工設計自組裝高選擇性鉀離子通道的特征,并對比了一系列的人工鉀離子通道單晶結構特點及其跨膜運輸的特點。同時,他們還分析探討了該領域的未來發展前景與挑戰。相關研究成果以“Encapsulation versus Self-Aggregation toward Highly Selective Artificial K+ Channels”為題發表在Account of chemical research上。