
近日,我校生命科學學院屈良鵠教授課題組在國際知名學術期刊EMBO Reports上發表了題為“An LTR retrotransposon-derived lncRNA interacts with RNF169 to promote homologous recombination”的研究論文。該研究首次揭示了人類LTR逆轉座子衍生的長鏈非編碼RNA(LTR-lncRNA)促進DNA同源重組修復的新功能。
在人類基因組中,逆轉座子元件及其衍生物的序列約占40%,其中10%為LTR逆轉座子。雖然大部分LTR 逆轉座子都具有產生轉錄本的潛能, 但是一直被認為是垃圾DNA和寄生轉錄產物,它們在重要細胞生物學過程中的作用并不清楚。屈良鵠教授課題組采用RNA組學技術,從肝癌TCGA數據中鑒定并命名了一個與p53突變相關的、由LTR12C家族衍生的LTR-lncRNA成員PRLH1。該研究發現,PRLH1可與DNA修復蛋白RNF169特異性結合,形成一個穩定的RNA-蛋白質機器,通過排除DSB位點的53BP1蛋白(非同源重組修復關鍵蛋白),啟動DNA同源重組修復(HR)。在這一過程,PRLH1對RNF169的穩定性至關重要。研究還發現,p53可通過NF-Y通路抑制PRLH1在肝癌中表達及其介導的HR修復。p53突變將導致癌細胞同源重組激活,成為癌細胞抵抗凋亡及耐藥性的基礎,該研究首次揭示了p53通過lncRNA轉錄調控這種新的作用方式來抑制HR修復(如下圖)。
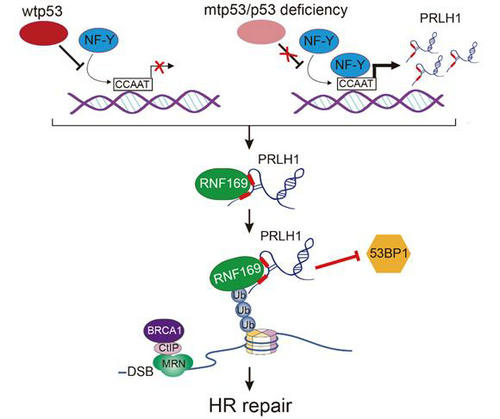
LTR-lncRNA 轉錄調節和功能機制的模型圖
該研究發現了LTR-lncRNA可參與形成一種新的RNA-蛋白質機器—DNA同源重組修復體(HR repairosome),揭示了LTR逆轉座子這類巨大的“垃圾DNA”調控重大細胞活動的新機制,不僅對人類遺傳與進化具有重要意義,而且為腫瘤等重大疾病診療提供了新的思路。我校生命科學學院屈良鵠教授、周惠教授及楊建華教授為共同通訊作者,2018屆博士鄧兵和2019屆博士許文麗為并列第一作者,我校生命科學學院為唯一作者單位。