
酶是一類具有高效率和特異催化活性的生物大分子,有效控制細胞內各種復雜反應。當在細胞外使用酶時,往往需要設計一個合適的“保護殼”以提高酶的穩定性。金屬有機框架(Metal-Organic Frameworks, MOFs)是一種是由有機配體和金屬離子或團簇通過配位鍵自組裝形成的具有分子內孔隙的有機-無機雜化材料,是一種理想、前沿的酶固定化材料。然而,當酶嵌入MOFs空腔內后,MOFs外殼往往會抑制底物的傳質速率和減少酶的活性位點利用率。因此,酶@MOFs復合材料的生物活性仍有待提高。
鑒于此,化學學院歐陽鋼鋒教授團隊開發一種簡單的合成策略,制備具有高活性的酶@MOFs生物雜交材料。該方法的關鍵在于添加了能夠作為“形貌調制器”的聚多肽-聚谷氨酸(γ-poly-L-glutamic acid, PLGA)。PLGA是一種陰離子生物聚多肽,不僅可通過靜電組裝方式調控酶的表面電荷進而加速酶@ZIF-8雜交材料的形成,而且PLGA直鏈上豐富的羧基基團可與金屬離子競爭配位,原位裁剪出具有不同形貌和孔徑尺寸的酶@ZIF-8納米結構(圖1A)。研究表明不同的納米結構對于雜交材料的活性有重要影響,其中設計的介孔2D酶@ZIF-8納米片結構由于具有更短的底物擴散路徑和更大的孔道尺寸,極大提高酶活性位點的利用率,因此得到的MOFs雜交材料具有優異的生物活性。基于提出的合成策略,研究人員還建立一個 MOFs“人造細胞”,通過酶級聯反應模擬細胞內的信號轉導(圖1B)。該人造細胞對葡萄糖具有雙重光學(熒光和比色信號)響應,兩種光學信號都與葡萄糖濃度成正比,并且在兩個互補的濃度范圍內靈敏。該研究成果發表在化學綜合期刊Angewandte Chemie International Edition,并遴選為VIP文章;同時,被多家國外科技媒體以 “Architecture is key: Biomolecule metal–organic hybrids with high bioactivity”為題作為亮點進行報道。
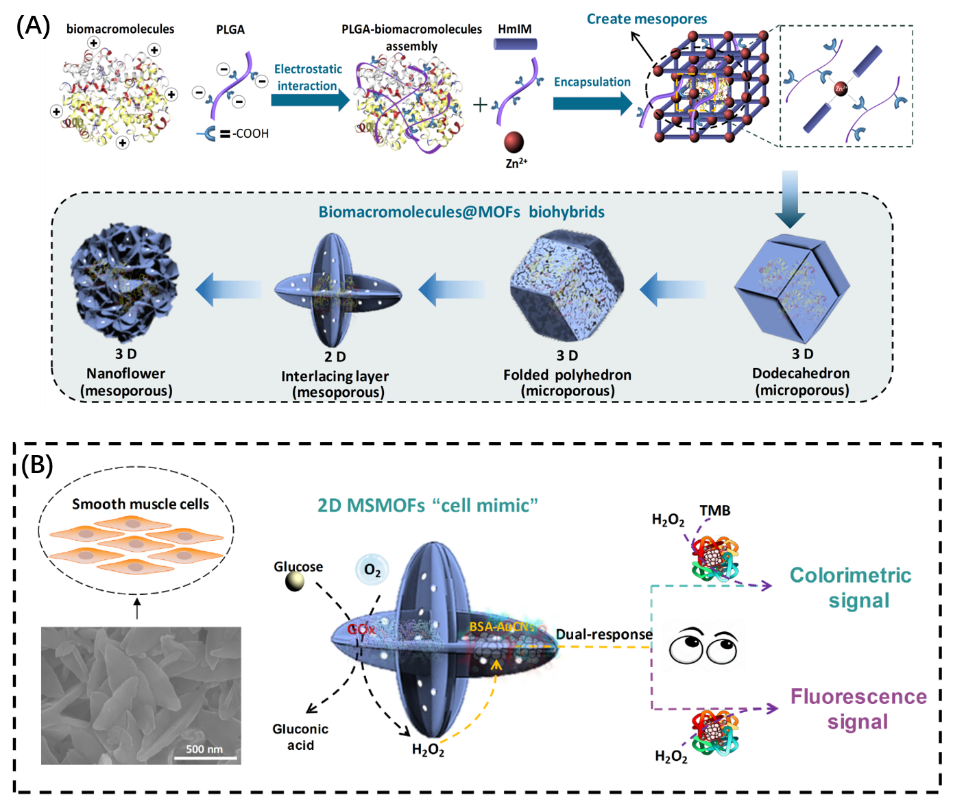
圖(A)聚多肽導向的酶@ZIF-8雜交材料合成示意圖;圖(B)葡萄糖雙重響應的MOFs“人造細胞”