
在絕大多數(shù)真核細胞中,線粒體不斷進行著分裂(fission)和融合(fusion)以應對細胞的生理需求和外部環(huán)境的改變。這種動態(tài)平衡的失調會影響線粒體的正常生理功能,并導致一系列人類疾病的發(fā)生,例如多種神經(jīng)退行性疾病,代謝疾病和惡性腫瘤等。線粒體的融合包含兩個步驟,即由MFN介導的外膜融合和由OPA1介導的內膜融合。由于相關蛋白質機器結構信息的缺乏,線粒體融合的機制一直不甚明確。
2020年10月19日,中山大學腫瘤防治中心高嵩研究員和中科院生物物理所胡俊杰研究員應邀在細胞生物學領域著名綜述期刊Trends in Cell Biology(IF = 16)上以共同通訊作者發(fā)表了題為“線粒體融合:內外兼修”的綜述文章“Mitochondrial Fusion: The Machineries In and Out”。此文章總結了線粒體融合相關蛋白質機器的最新前沿研究進展及其所揭示的可能的融合機制,討論了線粒體融合研究對其他發(fā)動蛋白認知的啟示,并分析了線粒體內外融合蛋白突變分別導致遺傳性神經(jīng)疾病的分子機理。
該綜述在以下方面對線粒體融合機制進行了介紹:
1. 介導線粒體融合的蛋白質機器
線粒體融合會提升細胞氧化磷酸化的水平,并有助于線粒體DNA的損傷修復。介導線粒體外膜融合的基因mitofusin(哺乳動物包含MFN1和MFN2兩個同源基因,酵母中為單一的Fzo1)和介導內膜融合的OPA1(Optic atrophy 1)在二十世紀九十年代末期被陸續(xù)發(fā)現(xiàn)。然而,這些蛋白的性質(多聚、膜錨定)對研究它們的結構造成了很大困難。
2. 線粒體融合蛋白與發(fā)動蛋白dynamin的結構關聯(lián)
線粒體內外膜融合的分子機器均屬于發(fā)動蛋白(dynamin)超家族成員。dynamin超家族成員是一類介導膜塑形的多結構域的GTP酶(圖1)。介導膜分裂和膜融合的dynamin家族成員(fission dynamins and fusion dynamins)具有不同的特性。MFN和OPA1作為功能性的fusion dynamin,其結構與其他已知結構的dynamin家族蛋白有聯(lián)系,亦有區(qū)別。
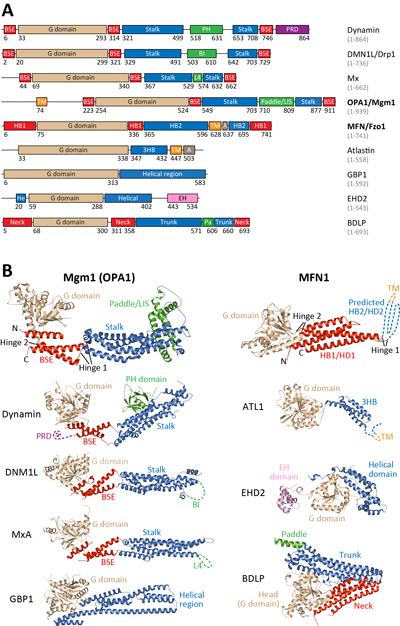
圖1:dynamin家族成員的結構。(A)結構域分布示意圖。(B)晶體結構對比。
3. MFN的結構與線粒體外膜融合
MFN介導的線粒體外膜融合包含栓連(tethering)、貼靠(docking)和合并(merger)三個連續(xù)的步驟。高嵩團隊和胡俊杰團隊分別報道了MFN1片段在不同GTP水解狀態(tài)下的晶體結構。MFN1在GTP水解過程中發(fā)生局部和整體的構象變化,并通過GTP酶結構域的二聚化來介導線粒體外膜的栓連。MFN2和MFN1雖然結構和功能類似,但在調控方式和疾病相關性方面存在一定差異。高嵩團隊近期研究發(fā)現(xiàn)靈長類 MFN2具有比MFN1更強的膜栓連效率。另一方面,MFN1和MFN2可以通過GTP酶結構域形成異源二聚體。MFN全長的結構目前仍然未知,因此線粒體外膜最終融合的機制并不十分明確。
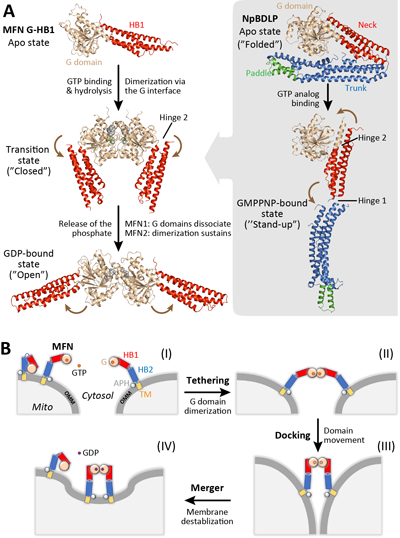
圖2:MFN介導線粒體外膜融合的機制。(A)MFN1/2的結構及其與BDLP的對比。(B)線粒體外膜融合過程示意圖。
4. OPA1/Mgm1的結構與線粒體內膜融合
在外膜融合后,內膜融合必須快速高效的跟進完成。此外,內膜融合蛋白OPA1/Mgm1需要發(fā)生部分水解,成為整合型和可溶性兩種形式,才能順利完成融合反應。此外,OPA1還需參與嵴的塑形。近期解析的多個OPA1/Mgm1結構表明,內膜融合蛋白呈現(xiàn)了“頭對頭”、“頭對尾”、“背靠背”等三種交互的界面,因此能以多種方式組裝。其中,頭對頭和背靠背界面可能參與了嵴的塑形,而融合則可能以來頭對尾的串聯(lián)形成小規(guī)模的螺旋,從而在每側的膜上形成較不穩(wěn)定的膜凸起,當兩側的膜凸起對接時,內膜融合即可完成(圖3)。
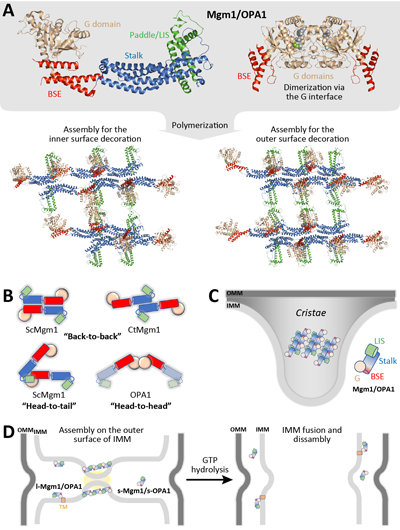
圖3:OPA1/Mgm1介導線粒體外膜融合的機制。(A)OPA1/Mgm1的結構。(B)Mgm1的聚合方式。(C)嵴塑形的機制。(D)線粒體內膜融合過程示意圖。
5. 線粒體融合研究的啟示
根據(jù)現(xiàn)有的融合模型,MFN2突變大多直接影響了線粒體外膜的拴連和融合,而OPA1突變則更多的影響了嵴塑形或蛋白穩(wěn)定,從而間接破壞內膜融合。線粒體融合蛋白的研究幫助我們提煉出鑒別發(fā)動蛋白究竟是介導融合還是裂解的規(guī)律:融合類發(fā)動蛋白更多依賴二聚化,而裂解類發(fā)動蛋白傾向于形成多聚體;融合類發(fā)動蛋白基本都為整合膜蛋白,而裂解類發(fā)動蛋白則多為外周膜蛋白。
總結與展望
結構分析在線粒體融合機制研究中起到關鍵作用。然而,一些關鍵的結構尚未被解析。除了傳統(tǒng)的結構解析手段,cryo-ET和FRET等生物物理技術也將在線粒體融合研究中起到重要作用。MFN和OPA1的全長分子如何工作,其介導的內外膜融合如何協(xié)調發(fā)生也是領域關注的重點。由此,內外膜融合機器的體外共重組,即雙層膜的體外重組的實現(xiàn)將是線粒體融合機制下一步研究的關鍵所在。
該工作受到國家重點研發(fā)計劃、國家自然科學基金等項目的資助。
論文鏈接:https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(20)30188-4