
表觀遺傳修飾主要包括翻譯后組蛋白修飾、DNA修飾和RNA修飾,它們可以通過調節轉錄和染色質結構來影響基因表達。最新研究表明組蛋白和RNA去甲基酶有希望成為有效的抗腫瘤靶標。表觀遺傳調節涉及到多種組蛋白、DNA和RNA修飾相關蛋白的協同作用,同時調控這些修飾有可能發揮協同抗癌作用。然而,許多表觀遺傳調節蛋白尚無有效的抑制劑/激活劑,因此,發揮這些修飾的協同作用面臨巨大挑戰。最近研究發現,干擾線粒體代謝和鐵穩態是非常有前景的抗癌策略。線粒體代謝中的中間產物是組蛋白/DNA/RNA去甲基化酶的輔因子或天然的抑制劑;而鐵則是這些生物大分子Fe(II)/2-氧代戊二酸依賴性去甲基酶的活性中心。
近日,我校化學學院毛宗萬教授和譚彩萍副教授團隊設計了偶聯臨床鐵螯合劑的線粒體靶向錸(I)配合物,以期達到同時破壞線粒體代謝和細胞內鐵穩態的目的(圖1A)。其中,DFX-Re3可以將細胞中的鐵重新定位到線粒體,并干擾線粒體代謝,包括與表觀遺傳修飾密切相關的關鍵代謝物(圖1B),并對三陰性乳腺癌表現出高選擇性殺傷效果。此外,鐵的重新定位導致Fe(II)/2-氧代戊二酸依賴性去甲基酶的下調。結果顯示,DFX-Re3可以同時提高DNA、RNA和組蛋白的甲基化水平,最終改變RNA聚合酶II的活性以及基因表達圖譜。機制研究表明DFX-Re3可以誘導細胞免疫原性凋亡,并在體內表現出顯著的抗腫瘤活性。該研究提供了一種通過干預線粒體代謝和鐵穩態來調節癌癥表觀基因組的抗癌新策略。
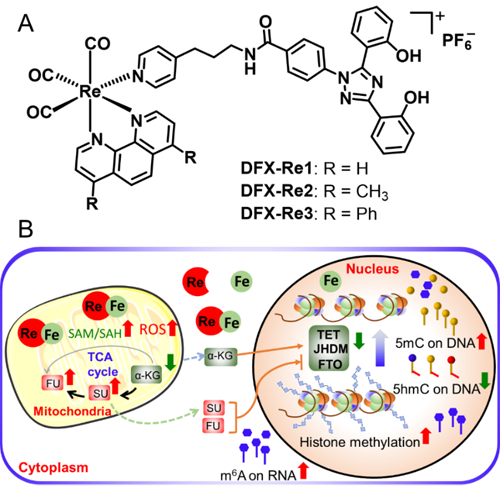
作用機制研究發現,該設計具有以下幾個顯著優勢:(1) DFX-Re3影響線粒體代謝中與表觀遺傳修飾相關的代謝物;(2) DFX-Re3將細胞鐵富集于線粒體并誘導線粒體產生大量活性氧;(3) DFX-Re3同時提高組蛋白、DNA和RNA的甲基化水平;(4) DFX-Re3改變轉錄組,尤其是RNA聚合酶II的活性;(5) DFX-Re3誘導細胞免疫原性凋亡并在體內表現出很高的抗癌活性。
該研究成果發表在化學頂級期刊Angew. Chem. Int. Ed.,并被評為VIP論文。題目為 “Recoding Cancer Epigenome by Intervening Metabolism and Iron Homeostasis with Mitochondria-Targeted Re(I) Complexes”, Angew. Chem. Int. Ed. 2020, 59, 18755-18762.
我校化學學院2017級博士研究生潘正銀為論文的第一作者,譚彩萍副教授、毛宗萬教授為共同通訊作者。上述研究工作得到了國家自然科學基金(21778078, 91953117,21837006),教育部創新團隊(No.IRT-17R111),廣東省自然科學基金(2015A030306023)和中央高校基礎研究經費等項目的資助。